微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 现有七种气体:① ?②
?②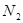 ?③
?③ ?④
?④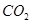 ?⑤
?⑤ ?⑥
?⑥ ,其中不能用排水法收集的气体是( )
,其中不能用排水法收集的气体是( )
A.①②③④⑤
B.①③⑤⑥
C.②③④⑤⑥
D.③④⑤⑥
2、实验题 (13分)(1)如图所示装置,为实现下列实验目的,其中y端适合于作入口的是_____多项)
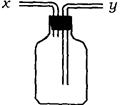
A 瓶内盛液体干燥剂,用以干燥气体
B 瓶内盛液体洗涤剂,用以除去某气体中的杂质
C 瓶内盛水,用以测量某难溶于水的气体的体积
D 瓶内贮存气体,加水时气体可被排出
E 收集密度比空气大的气体
F 收集密度比空气小的气体
(2) 浓H2SO4和木炭在加热时发生反应的化学方程式是_______________________。
图中虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,

填写下列空白。
①A中无水硫酸铜的作用_____________。
②证明SO2一定存在的现象是_____________。
③C中酸性KMnO4溶液的作用_____________。
④证明CO2一定存在的现象是_____________。
3、选择题 (20分)已知某化工厂的含镍催化剂主要含有Ni,还含有Al (31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。某校化学研究性学习小组通过查阅资料,设计了如下图所示的方法以该含镍废催化剂为原料来制备NiSO4·7H2O。
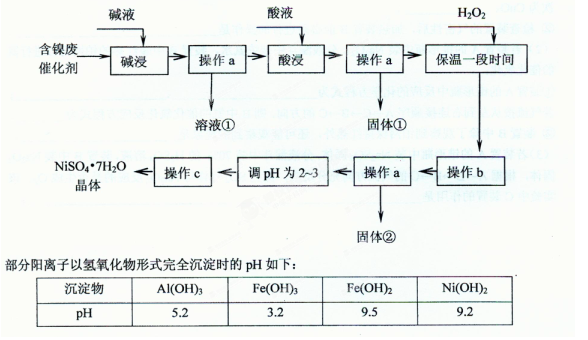
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为?????????。
(2)“碱浸”的目的是除去?????????。
(3)“酸浸”时所加入的酸是?????????(填化学式)。酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是?????????。
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是?????????。
(5)“调pH为2~3“的目的是?????????。
(6)产品晶体中有时会混有少量绿矾(FeSO4·7H2O),其原因可能是?????????。
(7) NiSO4在强碱溶液中用次氯酸钠氧化,可以制得碱性镍镉电池电极材料——NiOOH。该反应的离子方程式___?????????。
(8)一般认为残留在溶液中的离子浓度小于1×10-5 mol/L时,沉淀已经完全。请利用上表中数据估算Fe(OH)2的溶度积?????????和可逆反应Fe2++ 2H2O 2H++ Fe(OH)2在25℃时的平衡常数?????????
2H++ Fe(OH)2在25℃时的平衡常数?????????
4、实验题 (12分)Na2S2O3(俗称保险粉)在医药、印染中应用广泛,可通过下列方法制备:取15.1 gNa2SO3溶于80.0 mL水。另取5.0 g硫粉,用少许乙醇润湿后加到上述溶液中。小火加热至微沸,反应1小时后过滤。滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3·5H2O。
(1)加入的硫粉用乙醇润湿的目的是?????。
(2)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机化合物杂质是?????;其检测的方法是:取出少许溶液,加盐酸至酸性后,过滤除去S,再加BaCl2溶液。则加入的盐酸发生两个反应的化学方程式为:
Na2SO3+2HCl=SO2↑+H2O+2NaCl;?????。
(3)某环境监测小组用含0.100 mol·L-1Na2S2O3溶液[含少量的Na2SO3,且n(Na2S2O3) ∶n(Na2SO3)
= 5∶1]测定某工厂废水中Ba2+的浓度。他们取废水50.0 mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀硫酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,用上述Na2S2O3溶液进行滴定,反应完全时,测得消耗Na2S2O3溶液的体积为36.0 mL。
(已知有关反应的离子方程式为:①Cr2O72-+6I-+14H+???2Cr3++3I2+7H2O;
②I2+2S2O32-???2I-+S4O62-;③I2+SO32-+H2O???2I-+SO42-+2H+)
则滴定过程中可用?????作指示剂。计算该工厂废水中Ba2+的物质的量浓度。
5、选择题 下列气体实验室制备时,可以用相同发生装置的是?
A.O2 HCl
B.Cl2 H2
C.HCl Cl2
D.CO2 HCl