微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于电离度的叙述正确的是
A?电离度越小,表示弱电解质越弱
B?对同一弱电解质一般是浓度越小,温度越高,电离度越大
C?向醋酸溶液中滴加浓盐酸,则两种酸的电离度均变小
D?弱电解质的电离度随溶液的稀释而增大,在不断稀释过程中,溶液的导电性不断增强.
参考答案:B
本题解析:弱电解质在溶液里达电离平衡时,已电离的电解质分子数占原来总分子数(包括已电离的和未电离的)的百分数。A不正确,电离度小,弱电解质不一定越弱,所以B是正确的。盐酸是强电解质,不存在电离度,C不正确。稀释有利于电离,但溶液的导电性是降低的,D不正确。答案选B。
本题难度:一般
2、选择题 下列说法中正确的是
A.金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物
B.难溶于水的电解质不一定是弱电解质
C.氨气的水溶液可以导电,说明氨气是电解质
D.漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的
参考答案:B
本题解析:金属氧化物不一定是碱性氧化物,如过氧化钠,非金属氧化物不一定是酸性氧化物如一氧化碳,A错;电解质的强弱与物质的溶解性无关,电解质的强弱只看电解质在水中是否完全电离,若全电离则为强电解质,部分电离则为弱电解质,如碳酸钙虽然难溶于水但是溶于水的部分完全电离其属于强电解质,所以B正确;氨气水溶液能导电是因为氨气与水反应生成了一水合氨,一水合氨发生电离才可以导电,一水合氨属于电解质,但是氨气属于单质,既不是电解质也不是非电解质。C错;漂白粉用于自来水处理是因为漂白粉与空气中二氧化碳反应生成次氯酸,利用次氯酸的强氧
本题难度:简单
3、选择题 以0.10mol/L的氢氧化钠溶液滴定某一元弱酸的滴定曲线如图所示。横轴为加入氢氧化钠的体积数,纵轴为溶液的pH。下列正确的是
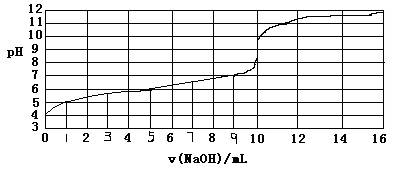
A.此一元弱酸的电离常数(Ka)约为1.0×10-6
B.此弱酸的浓度为1×10-4mol/L
C.此实验最好选用甲基红(变色范围在4.2~6.3)作指示剂
D.此滴定反应为吸热反应
参考答案:A
本题解析:
试题分析:由图象可知,起始酸的pH为4,故c(H+)=10-4mol/L,故酸的浓度必大于10-4mol/L,B项错误;此滴定终点为pH=10,溶液显碱性而甲基红变色范围4.2~6.3,显酸性,故应选择酚酞作指示剂,故C项错误;酸碱中和反应为发热反应,故D项错误;设一元酸为HA,由图可知当加入NaOH溶液5ml时溶液溶质恰好为HA、NaA物质的量之比1:1的混合物,故Ka=
 1.0×10-6,故A项正确;本题选A。
1.0×10-6,故A项正确;本题选A。
考点:酸碱中和滴定。
本题难度:一般
4、填空题 现有下列化合物①NaCl、②NaOH、③HCl、④NH4Cl、⑤CH3COONa、⑥CH3COOH、⑦NH3·H2O、
⑧H2O,回答问题:
(1)NH4Cl溶液显________性,用离子方程式表示____________________。
(2)pH=10的CH3COONa溶液中,水电离出来的c(OH-)为_________,在pH=3的CH3COOH溶液中水电离出来的c(H+)为________。
(3)已知水存在如下平衡:H2O+H2O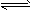 H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是_________。
H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是_________。
A. 向水中加入NaHSO4固体
B. 向水中加入Na2CO3固体
C. 加热至100℃
D. 向水中加入(NH4)2SO4固体
(4)若等pH、等体积的②(NaOH)和⑦(氨水)分别加水稀释m倍、n倍,稀释后pH相等,则m_____(填“>”“<”或“=”)n。
参考答案:(1)酸;NH4++H2O![]() 本题解析:
本题解析:
本题难度:一般
5、选择题 下列溶液中各微粒的浓度关系正确的是
A.等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH+4)=c(K+)=c(Ba2+)
B.0.2 mol·L-1的某一元弱酸HA溶液和0.l mol·L-1NaOH溶液等体积混合后的溶液:
2c(OH-)+ c(A-)=c(HA)+2 c(H+)
C.向NH4HCO3溶液中滴加NaOH溶液至pH=7:c(NH4+)+ c(Na+)=c(HCO3-)+ c(CO32-)
D.将10 mL 0.l mol·L-1 Na2CO3溶液逐滴滴加到10 mL 0.l mol·L-1盐酸中:
c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
参考答案:B
本题解析:
试题分析:A、等pH的氨水、KOH溶液、Ba(OH)2溶液中氢氧根和氢离子浓度相等,则根据电荷守恒可知:c(NH+4)+ c(H+)= c(OH-)、c(K+)+ c(H+)=c(OH-)、2c(Ba2+)+ c(H+)=c(OH-),所以c(NH+4)=c(K+)=2c(Ba2+),A不正确;B、0.2 mol·L-1的某一元弱酸HA溶液和0.l mol·L-1NaOH溶液等体积混合后的溶液是NaA和HA的混合液,且二者的浓度相等,因此根据电荷守恒和物料守恒可知c(Na+)+ c(H+)= c(
本题难度:一般