微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 pH值相等、体积相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌全部溶解且放出的气体一样多,为此下列说法正确的是:
A.反应开始时的速率:甲<乙
B.反应所需的时间:甲<乙
C.反应开始时,酸的物质的量浓度:甲<乙
D.反应结束时,pH值:甲<乙
参考答案:C
本题解析:醋酸是弱酸,在pH相同的条件下,醋酸的浓度大于盐酸的,在反应过程中醋酸的电离向正反应方向移动,所以在反应过程中,醋酸的反应速率大。开始时氢离子的浓度相同,所以反应速率相同。所以正确的答案选C,其余都是错误的。答案选C。
本题难度:一般
2、选择题 下列情况下,反应速率相同的是
A.等体积0.1 mol/L HCl和0.1 mol/L H2SO4分别与0.2 mol/L NaOH溶液反应
B.等质量锌粒和锌粉分别与等量1 mol/L HCl反应
C.等体积等浓度HCl和HNO3分别与等质量的Na2CO3粉末反应
D.等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质石灰石反应
参考答案:C
本题解析:试题分析:A中氢离子的浓度不同,反应速率不同;B中锌的表面积不同,反应速率不同;C中盐酸和硝酸都是一元强酸,所以在浓度相同的条件下,和碳酸钠的反应相同,C正确;D中稀硫酸和碳酸钙反应生成的微溶性的硫酸钙,附着在碳酸钙表面,从而阻止反应的进行。D不正确,答案选C。
考点:考查反应速率的有关判断
点评:该题是中等难度的试题,侧重对学生能力的培养。该题设计新颖,基础性强,有利于培养学生的逻辑推理能力和灵活应变能力。该题的易错点是选项D。
本题难度:困难
3、选择题 将20mL0.4?mol·L-1硝酸铵溶液跟50mL?0.1?mol·L-1氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是
A.c(NO3-)> c(OH-)> c(NH4+) > c(Ba2+)
B.c(NO3-) > c(Ba2+) > c(OH-) > c(NH4+)
C.c(Ba2+) > c(NO3-) > c(OH-) > c(NH4+)
D.c(NO3-) > c(Ba2+) > c(NH4+) > c(OH-)
参考答案:B
本题解析:分析:先计算硝酸铵和氢氧化钡的物质的量,再利用硝酸铵和氢氧化钡的反应来分析反应后所得溶液中各种离子的物质的量的多少.
解:20mL?0.4mol/L硝酸铵溶液中硝酸铵的物质的量为20mL×10-3L×0.4mol/L=0.008mol,
5 0mL?0.1mol/L氢氧化钡溶液中氢氧化钡的物质的量为50mL×10-3L×0.1mol/L=0.005mol,
硝酸铵和氢氧化钡混合以后发生反应:2NH4NO3+Ba(OH)2=Ba(NO3)2+2NH3?H2O,
则反应后,70ml溶液的组成为:剩余氢氧化钡0.001mol,生成的硝酸钡0.004mol,生成的一水合氨0.008mol,
在体积一样的前提下,物质的量越大,浓度越大,故c(NO3-)>c(Ba2+),
而氨水能电离出少量且相等的铵根和氢氧根,氢氧化钡中还有0.002mol的氢氧根,所以c(OH-)>c(NH4+),
故离子浓度大小顺序为:c(NO3-)>c(Ba2+)>c(OH-)>c(NH4+).
故选B.
点评:本题考查学生溶液混合以后离子浓度大小的比较问题,关键是找出反应以后溶液的组成以及各个离子的量的多少,是现在高考的热点和难点.
本题难度:一般
4、填空题 (8分)有关短周期元素A、B、C、D、E、F的信息如下:
元素
| 有关信息
|
A
| 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐
|
B
| 最外层电子数是次外层电子数的2倍
|
C
| M层上有3个电子
|
D
| 短周期原子半径最大的主族元素
|
E
| 其单质是淡黄色固体
|
F
| 最高正价与最低负价代数和为6
请回答下列问题:
(1)写出基态A原子外围电子的电子排布图 。气态氢化物乙中A原子的杂化类型是 。
(2)E、F两元素的电负性大小比较:E F(选填>、<或=)
(3)下列说法正确的是________(填序号)。
①实验室可用下图所示装置制取B的最高价氧化物。

②用C单质做成的槽车,都可用来运输甲的浓溶液。
③C形成的单质熔点低于D形成的单质的熔点。
④E的氢化物稳定性强于F的氢化物稳定性。
(4)将E的常见氧化物(该氧化物能使品红溶液褪色)通入由CuSO4和NaCl混合的浓 溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀进行元素质量分数分析,可知其中含Cl:35.7%,Cu:64.3%,则该氧化物在上述反应中的作用是________。
A.漂白剂 B.氧化剂 C.还原剂
参考答案:(8分)(除(1)题每空1分,其余每空2分)
(1)<
本题解析:
试题分析:元素的最高价氧化物的水化物与气态氢化物反应的元素是N元素,硝酸与氨气反应生成硝酸铵,所以A是N元素;最外层电子数是次外层电子数的2倍的元素的次外层不可能是8个电子,所以只能是2个电子,则该元素有2层电子,分别是2、4,所以B是C元素;C元素的M层上有3个电子,则C是Al元素;短周期原子半径最大的主族元素是Na元素,在前三周期中Na的原子半径最大,所以D是Na元素;单质是淡黄色固体的元素是S,硫单质是淡黄色固体,所以E是S元素;最高正价与最低负价代数和为6的最低价位-1,最高价为+7,所以F是Cl元素。
(1)N原子的外围电子是2s22p3,电子排布图为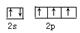 ;NH3分子中N原子的价层电子对数是3+1/2(5-3)=4,所以N原子的杂化方式是sp3杂化; ;NH3分子中N原子的价层电子对数是3+1/2(5-3)=4,所以N原子的杂化方式是sp3杂化;
(2)S与Cl比,Cl的电负性大于S,因为同周期中,随核电荷数的增加,原子吸引电子的能力增强;
(3)①用石灰石与稀盐酸反应制取二氧化碳气体,可以用如图装置,正确;②Al常温下与浓硝酸发生钝化,反应停止,所以可用Al槽车运输浓硝酸,正确;③Al的核电荷数大,原子半径小于Na,所以金属键较强,熔点高,错误;④S的非金属性比Cl弱,所以气态氢化物的稳定性比Cl弱,错误,答案选①②;
(4)使品红溶液褪色的含S化合物是二氧化硫,根据沉淀中的元素分析,含Cl:35.7%,Cu:64.3%,可知该沉淀中Cl与Cu的原子个数比是35.7/35.5:64.3/64=1:1,所以该沉淀的化学式是CuCl,所以Cu元素的化合价从+2价降低为+1价,所以硫酸铜做氧化剂,则二氧化硫是还原剂,答案选C。
考点:考查元素的推断,元素周期律的应用,电子排布图、杂化方式的判断,化学式的判断
本题难度:困难
5、选择题 下列各组物质中,全部属于纯净物的是
A.福尔马林、白酒
B.TNT、乙醇钠
C.汽油、无水酒精
D.冰醋酸、石油
参考答案:B
本题解析:试题分析:由一种物质构成的是纯净物,由2种或2种以上的物质构成的是混合物,A中全部是混合物,汽油、石油都是混合物,所以正确的答案选B。
考点:考查混合物、纯净物的正误判断
点评:该题是基础性试题的考查,难度不大。该题的关键是明确纯净物和混合物的概念,另外还需要熟练记住常见物质的组成,学生不难得分。
本题难度:困难
|