微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列分散系中存在溶质的电离平衡的是
A 硝酸溶液?? B 氢氧化钙溶液? C硫酸钡悬浊液? D 氢氧化铜悬浊液
参考答案:D
本题解析:弱电解质存在电离平衡。氢氧化铜为弱碱,属于弱电解质。
本题难度:一般
2、选择题 常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表
实验编号
| c(HA)/mol·L—1
| c(NaOH)/mol·L—1
| 混合溶液的pH
|
甲
| 0.1
| 0.1
| pH=a
|
乙
| 0.2
| 0.2
| pH=9
|
丙
| c1
| 0.2
| pH=7
|
丁
| 0.2
| 0.1
| pH<7
下列判断不正确的是
A.a<9
B.c1<0.2
C.在乙组混合溶液中c(OH—)—c(HA)=10—9 mol/L
D.在丁组混合液中c(Na+)<c(A—)
参考答案:B
本题解析:
试题分析:由表中甲组数据可知,一元酸HA和NaOH溶液等体积、等浓度混合,二者恰好反应,NaA溶液浓度为乙组NaA溶液浓度的一半,浓度对溶液的碱性影响大于电离程度,碱性比乙组的碱性弱,即pH<9,所以a<9,故A错误;一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,二者恰好反应,溶液pH=9,由表中数据可知丙组溶液呈中性,酸HA应过量些,故c1>0.2,故B错误;pH=9NaA溶液中c(H+)=10-9mol/L,氢氧根来源与水的电离与A-的水解,水每电离产生1个氢离子同时产生1个氢氧根离子,A-水解,生成1个HA分子同时生成1个氢氧根离子,所以溶液中c(OH-)=c(AH)+c(H+),故混合液中c(OH-)-c(HA)=10-9mol/L,故C正确;D、溶液呈电中性,一定存在c(OH-)+c(A-)=c(Na+)+c(H+),溶液pH<7,则c(OH-)<c(H+),所以c(A-)>c(Na+),故D错误.答案选B.
考点:pH的计算
本题难度:一般
3、选择题 将H+浓度相同,溶液体积也相同的两种酸溶液(甲:盐酸;乙:醋酸)分别与锌反应,若最后有一溶液中有锌剩余,且放出的气体一样多,对此有如下判断:
(1)反应所需时间乙<甲(2)开始时反应速率甲>乙(3)参加反应的锌的质量甲=乙(4)整个反应阶段的平均速率乙>甲(5)盛盐酸的容器中有锌剩余(6)盛醋酸的容器中有锌剩余
以上判断正确的是(??? )
A.(1)(2)(3)(5)
B.(1)(3)(5)
C.(2)(3)(6)
D.(1)(3)(4)(5)
参考答案:D
本题解析:盐酸是强酸,醋酸是弱酸,当两者H+浓度相同时,醋酸浓度比盐酸浓度大得多。依题意与锌反应放出的氢气一样多,则参加反应的锌以及参加反应的酸一样多,故盐酸反应完,醋酸有剩余。盐酸中有锌剩余。由于两者H+浓度相同所以开始反应速率相等,但由于醋酸存在电离平衡,当H+浓度减小时平衡右移补充H+浓度,故反应较快。
本题难度:简单
4、填空题 (6分)A、B两种物质都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合,要求A1 溶液中的水的电离程度小于A2 溶液中水的电离程度;B1 溶液中的水的电离程度小于B2溶液中水的电离程度;
(1)请写出下列各物质的化学式:
A1 ??????????????A2??????????????B1???????????????B2???????????
(2)B1溶液中的水的电离程度小于B2溶液中水的电离程度,其原因是:
___________________________________________________________________
参考答案:(1)A1 NaOH???? A2 NaNO2??? B1
本题解析:A1 溶液中的水的电离程度小于A2 溶液中水的电离程度,说明A1是碱,A2是盐水解显碱性。B1 溶液中的水的电离程度小于B2溶液中水的电离程度,同样可知B1是酸,B2是盐水解显酸性。所以正确的组合是A1 NaOH???? A2 NaNO2??? B1 HNO3??? B2?NH4NO3。
本题难度:一般
5、填空题 (10分)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题: 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
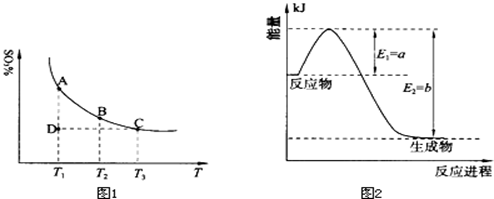
①恒温、恒压条件下,反应2SO2(g)+O2(g) 2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”); 2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2(填“>”、“<”或“=”,下同);若反应进行到状态D时,v正 v逆(填“>”、“<”或“=”)。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①上图2是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: .(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水.在25℃下,将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液恰好显中性,用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)已知25°C时Ksp[AgCl]=1.6×10-10mol2?L-2,Ksp[AgI]=1.5×10-16mol2?L-2),在25℃下,向0.1L0.002mol?L-1的NaCl溶液中逐滴加入0.1L0.002mol?L-1硝酸银溶液,有白色沉淀生成.从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1L0.002mol?L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
参考答案:(1)① 向左
本题解析:
本题难度:困难
|