微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向22.4g的Fe2O3、Cu的混合物中加入0.5mol/L的硫酸溶液600mL时,固体恰好完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为 ?
A.6.4g
B.4.8g
C.2.4g
D.1.6g
参考答案:B
本题解析:
试题分析:由题意可知反应后的溶液中溶质为和FeSO4和CuSO4,故Fe2O3和Cu的物质的量之比为1:1其物质的量都为0.1mol,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量应为Fe2O3中O的质量,故减少的质量为0.1×3×16=4.8g,故B正确。
本题难度:一般
2、简答题 用18mol/L?浓硫酸配制100ml?3.0mol/L?稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积?????②量取一定体积的浓硫酸
③溶解???④转移、洗涤????⑤定容、摇匀
回答下列问题
(1)所需浓硫酸的体积是______,量取浓硫酸所用的量筒的规格是______
(从下列中选用??A.10ml???B.20ml???C.50ml???D.100ml)
(2)第③步实验的操作是______.
(3)第⑤步实验的操作是______.
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A.所用的浓硫酸长时间放置在密封不好的容器中______
B.容量瓶用蒸馏洗涤后残留有少量的水______
C.所用过的烧杯、玻璃棒未洗涤______
D.定容时俯视溶液的液凹面______.
参考答案:(1)设浓硫酸的体积为V,18mol/L×V=0.1L×3.
本题解析:
本题难度:一般
3、计算题 (10分)实验室在加热条件下制取Cl2的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。现将17.4 g MnO2投入到400 g质量分数为36.5%的浓盐酸(浓盐酸过量)中加热,充分反应后(不考虑盐酸挥发),求:
MnCl2+Cl2↑+2H2O。现将17.4 g MnO2投入到400 g质量分数为36.5%的浓盐酸(浓盐酸过量)中加热,充分反应后(不考虑盐酸挥发),求:
(1)标准状况下生成Cl2的体积为多少? (2)剩余HCl的物质的量为多少?
参考答案:4.48L;3.2mol
本题解析:
试题解析:8.7MnO2的物质的量=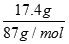 =0.2mol,则:
=0.2mol,则:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
1 4 1
0.2mol n(HCl) n(Cl2)
n(Cl2)=n(MnO2)==0.2mol,V(Cl2)=22.4L/mol×0.2mol=4.48L;(2)原溶液中氯化氢的物质的量= =4mol,反应过程中消耗的氯化氢的物质的量=0.2mol×4=0.8mol,故反应后剩余氯化氢的物质的量=4mol-0.8mol=3.2mol。
=4mol,反应过程中消耗的氯化氢的物质的量=0.2mol×4=0.8mol,故反应后剩余氯化氢的物质的量=4mol-0.8mol=3.2mol。
考点:化学方程式的有关计算
本题难度:一般
4、选择题 硫酸越浓密度越大.现有98%的硫酸溶液的物质量浓度为C1,49%的硫酸溶液的物质量浓度为C2,则C1和C2的关系( )
A.C1=2C2
B.C1>2C2
C.C1<2C2
D.无法确定
参考答案:设98%的硫酸溶液的密度为ρ1g/ml,49%的硫酸溶液的为
本题解析:
本题难度:简单
5、选择题 下列说法正确的是( )
A.摩尔是一种国际基本物理量
B.标准状况下气体摩尔体积约为22.4L
C.1mol氧的质量为16g
D.1molH2O的质量为18g
参考答案:D
本题解析:
本题难度:简单