微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)在一定温度下,向一2L固定容积的密闭容器中通入20 molN2和60 molH2,经过5分钟后,N2的浓度是5mol∕L,又过了5分钟 N2、H2、NH3的浓度不再变化,此时NH3的浓度是14 mol∕L,达到平衡后共放出QKJ的热量,试完成下列问题:
⑴前5分钟用H2表示的化学反应速率(????????????????????);
⑵反应达到平衡后N2的转化率(?????????????????);
⑶表示该温度下合成氨的化学平衡常数的表达式为(??????????????);
⑷若平衡后再增大压强,化学平衡向(????????)方向移动(填“正”“逆”“不”);
⑸该温度下反应的热化学方和式为(???????????????)(用含Q的式子表示);
⑹在该温度下,向另一2L固定容积的密闭容器中通入N2 5 mol、H215 mol、NH330 mol,反应达到平衡后H2的浓度是(????????????????)。
2、选择题 下列因素能改变化学反应的活化能的是( )
A.温度
B.压强
C.反应物的浓度
D.催化剂
3、选择题 少量铁粉与100ml0.01mol/L稀盐酸反应。为了加快速率而不改变H2产量,可以使用如下方法中的:①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加NaCl溶液 ⑤滴加几滴硫酸铜溶液 ⑥适当升高温度(不考 虑盐酸挥发) ⑦改用10ml 0.1mol/L的盐酸
A.③⑤⑥⑦
B.③⑥⑦
C.③④⑤⑥⑦
D.①③⑤⑦
4、选择题 在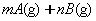

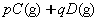 反应中,达到平衡后,的质量分数D%随温度、压强的变化曲线如下图所示正确的结论是(???)。
反应中,达到平衡后,的质量分数D%随温度、压强的变化曲线如下图所示正确的结论是(???)。
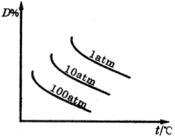
A.正反应放热,且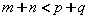
B.正反应放热,且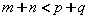
C.正反应吸热,且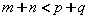
D.正反应吸热,且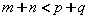
5、实验题 (14分?每空2分)化工原料红矾钠(重铬酸钠:Na2Cr2O7·2H2O)主要是以铬铁矿(主要成分为FeO·Cr2O3,还含有Al2O3、SiO2等杂质)为主要原料生产,其主要工艺流程如下:
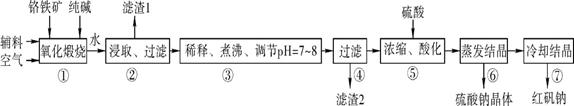
步骤①中主要反应的化学方程式如下:
4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(1) ①中反应是在回转窑中进行的,反应时需不断搅拌,其作用是 ?????????。
(2) 杂质Al2O3在①中转化的化学反应方程式为 ??????????? 。
(3) 用化学平衡移动原理说明③中煮沸的作用是 (用离子方程式结合文字说明),若调节pH过低产生的影响是 。
(4) ⑤中酸化是使CrO42-转化为Cr2O72-写出该反应的离子方程式: ??????????。

(5) 工业上还可用电解法制备重铬酸钠,其装置示意图如上。
阴极的电极反应式为 ????????????????????????????????;
阳极的电极反应式为 ????????????????????????????????。