微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知锌及其化合物的性质与铝及其化合物相似。如图,横坐标为溶液的pH,纵坐标为Zn2+离子或
[Zn(OH)4]2-离子的物质的量浓度(假设Zn2+离子浓度为10-5mol·L-1时,Zn2+离子已沉淀完全)。下列说法不正确的是
 [???? ]
[???? ]
A.往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:Zn2++4OH-=[Zn(OH)4]2-
B.从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17
C.某废液中含Zn2+离子,沉淀Zn2+离子可以控制溶液pH的范围是8~12
D.向1L 1 mol·L-1ZnCl2溶液中加入NaOH固体至pH=6,需NaOH 0.2mol
参考答案:D
本题解析:
本题难度:一般
2、选择题 向AgCl饱和溶液中加水,下列叙述正确的是 (???????? )
A.溶解度.Ksp均不变
B.溶解度.Ksp均变大
C.结晶过程停止,溶解过程加快
D.结晶过程将小于溶解过程,直至再达到平衡
参考答案:A
本题解析:在纯水中物质的溶解度和Ksp都只受物质性质和温度的影响,与其它外界条件无关,故A正确而B错误。沉淀的溶解平衡是和化学平衡一样的动态平衡,结晶过程和溶解过程都不会停止,而是结晶速率和溶解速率都改变。故C.D都不正确。
本题难度:一般
3、选择题 常温下,2.0×10-3mol?L-1氢氟酸的水溶液中,调节溶液pH(忽略溶液体积变化)得到的[HF]、[F-]与溶液pH的变化关系如下图.下列叙述不正确的是( )
(提示:Ka(CH3COOH)=1.8×10-5mol?L-1,Ksp(CaF2)=1.5×10-10mol3?L-3)
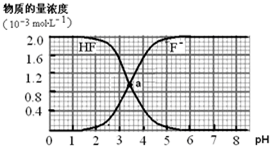
A.两条曲线交点a对应溶液的[F-]=[HF]
B.加入NaOH溶液至pH=7,溶液中[F-]=[Na+]
C.常温下HF的电离常数Ka(HF)>Ka(CH3COOH)
D.pH=4时,加入CaCl2固体使[Ca2+]=2.0×10-3mol?L-1,无CaF2沉淀析出
参考答案:A、纵轴是微粒浓度,横轴是溶液PH,两条曲线交点a对应溶液的
本题解析:
本题难度:简单
4、选择题 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。根据下图分析,下列判断不正确的是
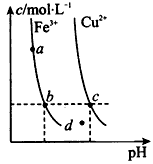 [???? ]
[???? ]
A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.加适量NH4Cl固体可使溶液由a点变到b点
C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
参考答案:B
本题解析:
本题难度:一般
5、选择题 要使工业废水中的重金属离子Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,
已知Pb2+与这些离子形成的化合物的溶解度如下:
化合物
| PbSO4
| PbCO3
| PbS
|
溶解度/g
| 1.03×10-4
| 1.81×10-7
| 1.84×10-14
由上述数据可知,选用的沉淀剂最好为
A.硫化物???????? B.硫酸盐????? C.碳酸盐?????? D.以上沉淀剂均可
参考答案:A
本题解析:
试题分析:根据溶度积常数可知,硫化铅的溶度积常数最小,所以最好的沉淀剂是硫化物,答案选A。
点评:对于组成和结构相似的化合物,其溶度积常数越小,沉淀时需要的离子浓度越小。据此可以判断和计算。
本题难度:一般
|