微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一个绝热容器中,放入Ca(OH)2悬浊液,有平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq)△H<0.已知:CaO(s)+H2O(l)═Ca(OH)2(s)△H<0.下列说法正确的是( )
A.向溶液中加少量CaO,达新平衡后,溶液的pH不变
B.向溶液中加少量CaO,达新平衡后,溶液的pH降低
C.向溶液中加入Na2CO3溶液,其中Ca(OH)2固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
参考答案:A.向饱和石灰水中加少量生石灰后不仅消耗水,溶液的温度也升高
本题解析:
本题难度:简单
2、选择题 常温 下,以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等,通过添加过量的难溶电解质MnS,可使这些金属离子形成硫化物沉淀并过滤除去,下列说法正确的是
A.过滤后的溶液中一定没有S2-
B.MnS难溶于水,可溶于MnCl2溶液中
C.常温时,CuS、PbS、CdS比MnS更难溶
D.加入MnS后生成CuS的离子方程式是Cu2+ + S2- = CuS↓
参考答案:C
本题解析:
试题分析:A、根据沉淀溶解平衡,过滤后的溶液一定含有S2?,故A错误;B、因为MnCl2溶液含有Mn2+,MnS在MnCl2溶液中溶解度更小,故B错误;C、根据添加过量的难溶电解质MnS,可使Cu2+、Pb2+、Cd2+形成硫化物沉淀,说明CuS、PbS、CdS比MnS更难溶,故C正确;D、MnS为难溶电解质,所以MnS不能拆成离子,故D错误。
考点:本题考查沉淀溶解平衡、离子方程式的书写。
本题难度:一般
3、填空题 在图(1)所示的装置中,烧杯中盛放的是Ba(OH)2溶液,当从滴定管中逐渐加入某种溶液(A)时,溶液的导电性的变化趋势如图(2)所示。
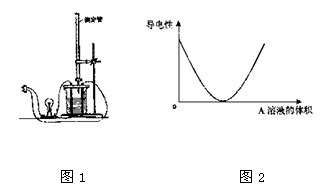
该根据离子反应的特点分析:A溶液中含有的溶质可能是_________或__________(至少写出两种),并写出相应的离子反应的离子方程式:
________________________________、____________________________
参考答案:H2SO4或CuSO4或MgSO4或(NH4)2SO4等。<
本题解析:从图2可分析知,随着A的加入溶液导电能力迅速降低,说明A必定能与Ba(OH)2发生反应,使溶液中离子浓度变得极小,故不仅与Ba2+反应转化为沉淀,还要与OH—反应生成水或其它弱电解质,当反应完全后,过量A的加入,导电能力又显著上升,说明A应为强电解质,
本题难度:简单
4、选择题 常温下,对于醋酸溶液的下列说法中,不正确的是
A.0.1 mol·L-1的醋酸溶液中加水稀释,溶液中c(OH-)减小
B.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
C.pH=4的醋酸溶液与pH=10的烧碱溶液等体积混合后溶液呈酸性
D.醋酸溶液中加入少量醋酸钾晶体,醋酸电离程度减小
参考答案:A
本题解析:醋酸是弱酸,存在电离平衡,稀释促进电离,但氢离子的浓度降低,所以c(OH-)增大,A不正确。C符合电荷守恒,正确。pH=4的醋酸溶液的浓度大于0.0001mol/L,所以反应中醋酸是过量的,溶液显酸性,C正确。增大醋酸根离子的浓度抑制醋酸的电离,D正确,答案选A。
本题难度:简单
5、选择题 已知常温时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=12.0,则下列说法不正确的是 (? )
A.所得溶液中的c(H+)=1.0×10-12 mol·L-1
B.所加的烧碱溶液pH=12.0
C.所得溶液中由水电离产生的c(OH-)=1.0×10-12 mol·L-1
D.所得溶液中的c(Mg2+)=5.6×10-8 mol·L-1
参考答案:B
本题解析:
试题分析:A、pH=12.0,所以c(H+)=10-12 mol/L;B、两溶液混合后c(OH-)="0.01" mol/L,所以烧碱中c(OH-)更大,故其pH>12,C、加碱抑制水的电离,所以水电离出的c(OH-)=10-12mol/L);D、c(OH-)="0.01" mol/L,故c(Mg2+)=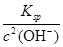 本题难度:一般
本题难度:一般