微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大。W原子核外有2个未成对电子,Q是电负性最大的元素,R元素的原子核外的未成对电子数是W原子核外未成对电子数的2倍。请回答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):
(l)W、Y、Z 三种元素的第一电离能由大到小的顺序为?。在上述三种元素的原子中,写出与WZ2互为等电子体的分子式?。
(2)已知Y2Q2分子存在如下所示的两种结构(球棍模型,短线不一定代表单键)

该分子中Y原子的杂化方式是?杂化。
(3)W2-2阴离子的电子式为?,Z原子最外层电子排布式为?。
(4)YQ3分子的空间构型为?,Y和Q两元素的氢化物的沸点相比较,高者是??(写分子式).往硫酸铜溶液中通入过量的YH3(Y的氢化物分子式),可生成配离子[Cu(YH3)4]2+,但YQ3不易与Cu2+形成配离子,其原因是?。
(5)科学家通过X射线探明RZ的晶体结构与NaCl晶体结构相似。那么在RZ晶体中距离R2+最近且等距离的R2+有?个。若在RZ晶体中阴阳离子间最近距离为a cm,晶体密度为ρg/cm3,则阿伏伽德罗常数NA的表达式为?mol-1。
(6)已知非整数比化合物R0.95?Z,其晶体结构与NaCI相似,但由于R、Z离子个数比小于1:1,故晶体存在缺陷。R0.95Z可表示为(?)

参考答案:
(1)N>O>C;? N2O
(2)SP2
(3) 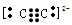 ; 2s22p4
; 2s22p4
(4)三角锥形;HF;由于电负性F>N>H,在NF3分子中,共用电子对偏向F原子,使得N原子上的孤电子对难与Cu2+配位
(5)12;36/ρa3
(6)B
本题解析:
(1)根据题意“W原子核外有2个未成对电子”,1s22s22p2,W应为C,“Q是电负性最大的元素”Q应为F,“R元素的原子核外的未成对电子数是W原子核外未成对电子数的2倍”,R的电子排布式应为[Ar]4s23d6,R为Fe,W、Y、Z的电负性关系为N>O>C;CO2的电子数为22,与其是等电子体的是N2O。
据键角为120 。,故Y原子的杂化方式应为SP2。
联想到CaC2,可写出C2-的电子式;Z为氧,最外层电子排布式为2s22p4。
联想NH3的空间构型,则NF3应为三角锥形。NH3与HF的沸点相比较,因电负性F>N,HF的氢键强于NH3的氢键,故HF沸点较高。氨易于与Cu2+形成配离子,而NF3难与Cu2+形成配离子,由于电负性F>N>H,在NF3分子中,共用电子对偏向F原子,使得N原子上的孤电子对难与Cu2+配位
首先对NaCl的晶体结构要熟悉,在晶体中间从三维方向用三个?面去切割,可以得到三个平面,在每一面上,距离中心Na+最近的 Na+有4个,则晶体中共有12个。据上面推得可知,R为Fe,则FleO的摩尔质量为72。在NaCl晶体中,每个晶胞含有4个NaCl,故FeO中,
NA(2a)3ρ/4=56+16,NA=36/a3ρ
(6)设R2+有x个,则R3+就有0.95-x,根据化合物化合价代数和为零的原则,有等式(+2X)+[+3(0.95-X)]+(-2)=0,解得X=0.85,故R0.95Z可表示为R0.852+R0.103+Z,选项B正确。
本题难度:困难
2、填空题 [物质与结构](12分)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(kJ/mol)
| I1
| I2
| I3
| I4
|
A
| 932
| 1821
| 15390
| 21771
|
B
| 738
| 1451
| 7733
| 10540
|
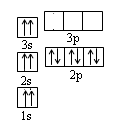
(1)某同学根据上述信息,推断B的基态原子核外电子排布如图所示,该同学所画的电子排布图违背了?。
(2)ACl2分子的空间结构为?(用文字描述)。
(3)我国部分城市雾霾天占全年一半,引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等,其中NO3-中N原子的杂化方式是??,与SO42-互为等电子体的分子是?。
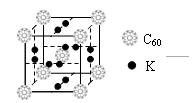
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物, 其
晶胞如图所示,该物质在低温时是一种超导体。该物质的化学式?
为?。
(5)继C60后,科学家又合成了Si60、N60, Si60分子中每个硅原子只跟相 邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为?。
参考答案:(1)泡利不相容原理?
(2) 直线型?
(3) sp2? CCl4、CF4?等
(4) K3C60
(5) 30
本题解析:元素AB的第2和第3电离能相差较大,故两种原子最外层均为2个电子,但B的第一电离能小金属性强,故AB分别为Be和Mg。(1)该原子的s轨道均排了自旋方向相同的电子,故不符合泡利不相容原理;(2)BeCl2分子价电子对数为(2+2)÷2=2,故为sp杂化为直线型;(3)NO3-中氮的价电子对数为(5+1)÷2=3,为sp2杂化;SO42-互为等电子体的分子为CCl4、CF4?等;(4)该晶胞中黑球有12×1/2=6,C60有8×1/8+1=2,K原子和C60分子的个数比为3:1,化学式为 K3C60;(5)硅原子应形成4个公用电子对才能达到8电子稳定结构,但其只与3个原子成键,因此与其中一个原子形成双键,双键中含有1个π键,每个双键两个硅原子共用,计算为1×1/2×60 =30.
本题难度:一般
3、选择题 下列各组物质气化或熔化时,所克服的粒子间的作用力属于同种类型的是
A.二氧化硅和生石灰的熔化
B.氯化钠和铁的熔化
C.碘和干冰的升华
D.氯化铵受热气化和苯的气化
参考答案:C
本题解析:
正确答案:C
克服的粒子间的作用力分别是A、共价键、离子键;B、离子键、金属键;C、分子间作用力、分子间作用力;D、离子键、分子间作用力;故选C。
本题难度:简单
4、选择题 下列物质中,存在离子键的是( )
A.二氧化硅
B.碘单质固体?
C.干冰
D.氯化钠固体?
参考答案:A.二氧化硅中只含共价键,故A错误;
B.碘单质中只含共价键,且为非极性共价键,故B错误;
C.干冰中只含共价键,且为极性共价键,故C错误;
D.氯化钠中只含离子键,为离子化合物,故D正确;
故选D.
本题解析:
本题难度:一般
5、选择题 下列物质中,属于离子化合物的是 ( )
A.N2
B.CO2
C.NaOH
D.CH4
参考答案:C
本题解析:由阴阳离子组成的化合物为离子化合物,选C。
本题难度:简单