微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 下图是周期表的一部分,A、B、C、D、E?5种元素的原子核外共含有80个质子.
(1)A、B、C、D、E的元素符号分别是:
A______,B______,C______,D______,E______
(2)A、B、C对应最高价氧化物的水化物的酸性由强到弱的顺序是(用化学式表示)______.
(3)A的最高价氧化物对应的水化物体现______?(填“酸性”、“碱性”、“两性”),用离子方程式表示为:______.
(4)E为______?(填“金属”、“非金属”),其单质可能为______?(填“导体”、“非导体”、“半导体”),推断理由是______.
参考答案:(1)由元素所在周期表位置可推断元素位于二、三、四周期,设B的原子序数为x,则A的原子序数为x-1,C的原子序数为x+1,D的原子序数为x-8,E的原子序数为x+18,则有x+x-1+x+1+x-8+x+18=80,x=14,所以A为Al元素,B为Si元素,C为P,D为C元素,E为Ge元素,
故答案为:Al;Si;P;C;Ge;
(2)A、B、C对应最高价氧化物的水化物分别为Al(OH)3、H2SiO3、H3PO4,同周期元素从左到右元素的非金属性逐渐增强,则对应的最高价氧化物的水化物的酸性逐渐增强,则有酸性:H3PO4>H2SiO3>Al(OH)3,故答案为:H3PO4>H2SiO3>Al(OH)3;
(3)A的最高价氧化物对应的水化物为Al(OH)3,为两性氧化物,既能与酸反应生成盐和水,又能与碱反应生成盐和水,反应的离子方程式分别为Al(OH)3+3H+═Al3++3H2O,Al(OH)3+OH-═AlO2-+2H2O,
故答案为:两性;Al(OH)3+3H+═Al3++3H2O,Al(OH)3+OH-═AlO2-+2H2O;
(4)E为金属元素Ge,位于金属元素和非金属元素分界线附近,为良好的半导体材料,
故答案为:金属;半导体;在周期表中处在金属元素和非金属元素分界线附近.
本题解析:
本题难度:一般
2、填空题 (1)铬的外围电子排布式是??,与铬同周期,最外层有3个未成对电子数的主族元素名称是??,该元素对应的最低价氢化物分子的中心原子采取了??杂化方式,分子的空间构型是 ?。
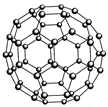
(2)富勒烯(C60)的结构如图,1molC60分子中σ键的数目为______ 。继C60后,科学家又合成了Si60、N60。请解释如下现象:熔点:Si60>N60>C60,而破坏分子所需要的能量: N60>C60>Si60,其原因是:??。
(3)氟化氢水溶液中存在氢键有?种。
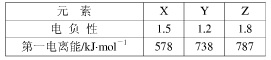
(4)2011年诺贝尔化学奖授予了因发现准晶体材料的以色列科学家。某准晶体是锰与另一个短周期元素X形成的凝固态。已知:金属的电负性一般小于1.8。元素X与同周期相邻元素Y、Z的性质如下表:则X元素符号是??,锰与X在准晶体中的结合力为?。
参考答案:(1)3d54s1?砷? sp3?三角锥?(各1分,共4分)
(2)90NA?(2分)?组成、结构相似的分子晶体,相对分子质量越大,分子间作用力(或范德华力)越强,熔化所需的能量越多,故熔点:Si60>N60>C60(1分);而破坏分子所需断开化学键,元素电负性越强其所形成的化学键越稳定,或成键电子数越多,成键原子半径越小,断键所需能量越多,故破坏分析需要的能量顺序为N60>C60>Si60(1分)(合理答案均可,各1分,共2分)
(3) 4?(2分)
(4)Al (2分)?金属键 (1分)
本题解析:(1)根据能量最低原理、洪特规则等规律,基态Cr原子外围电子排布式为3d54s1;价电子排布式为4s24p3的As符合要求,即砷;PH3中P采取sp3杂化方式,孤对电子与成键电子对形成正四面体形,则PH3分子为三角锥形;(2)读图可知,每个碳原子周围形成3个C—C键,每个C—C键被相邻2个碳原子共用,则1个碳原子可形成1.5个σ键,60个碳原子可形成90个σ键,1molC60分子含有90NA个σ键;组成、结构相似的分子晶体,相对分子质量越大,分子间作用力(或范德华力)越强,熔化所需的能量越多,故熔点:Si60>N60>C60;破坏分子所需断开化学键,元素电负性越强其所形成的化学键越稳定,或成键电子数越多,成键原子半径越小,断键所需能量越多,故破坏分析需要的能量顺序为N60>C60>Si60;(3)氟化氢水溶液中存在的氢键有F—H……F、F—H……O、O—H……F、O—H……O四种类型;(4)由表中信息可知X是铝,锰与铝以金属键结合。
本题难度:一般
3、选择题 下列物质中既有离子键又有共价键的是
[? ]
A、CaCl2?
B、H2O2?
C、KOH
D、H2S
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列过程中离子键被破坏的是
[? ]
A.NaCl溶于水
B.钠和硫受热熔化
C.碘和干冰升华
D.Na2SO4晶体受热熔化
参考答案:AD
本题解析:
本题难度:简单
5、选择题 下列化合物中既含离子键,又含共价键的化合物是( )
A.MgCl2
B.SiO2
C.H2O
D.NaOH
参考答案:D
本题解析:
本题难度:一般