微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 A、B、C、D、E均为中学化学的常见单质或化合物,它们之间的反应关系如图所示:
(1)若A是短周期中原子半径最大的元素构成的单质,E既可溶于盐酸又可溶于NaOH溶液,E溶于NaOH溶液的离子方程式是______;工业上冶炼A的化学反应方程式是______.
(2)若C是既含有极性键又含有非极性键的四原子分子,则实验室制取C的化学方程式是______;1mol?C完全燃烧生成液态水时放热1300kJ,则C完全燃烧的热化学方程式是______.A与盐B的溶液反应时只生成气体C、碳酸钙沉淀和水,则B的化学式是______.
参考答案:(1)A是短周期中原子半径最大的元素构成的单质,应为Na,E既可溶于盐酸又可溶于NaOH溶液,应为Al(OH)3,
Al(OH)3与NaOH溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,工业冶炼Na用电解熔融的NaCl的方法,反应的化学方程式为2NaCl(熔融)??电解?.??2?Na+Cl2↑,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;2NaCl(熔融)??电解?.??2?Na+Cl2↑;
(2)既含有极性键又含有非极性键的四原子分子有C2H2或H2O2,其中能燃烧的是C2H2,则A为CaC2,与水反应生成C2H2和Ca(OH)2,与B的溶液反应生成C2H2、水和碳酸钙,
则B为Ca(HCO3)2,
1molC2H2完全燃烧生成液态水时放热1300kJ,则2molC2H2完全燃烧放出2600kJ的热量,
所以完全燃烧的热化学方程式为2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-2600?kJ?mol-1,
故答案为:CaC2+2H2O→C2H2↑+Ca(OH)2;2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-2600?kJ?mol-1;Ca(HCO3)2.
本题解析:
本题难度:一般
2、填空题 (6分)已知物质A、B、C、D、E、F、G、H、I、J、X、Y有如下图所示的转化关系,其中气体A、B、C为常见非金属单质,X、Y为常见金属单质。(部分反应中生成物没有全部列出,反应条件未全部列出)

请按要求回答下列问题:
(1)气体E的电子式为?;
(2)G的化学式是___________;
(3)写出反应“I→J”的离子方程式?;
(4)金属X与NaOH溶液反应也能得到溶液H,试写出对应的化学方程式?。
参考答案:(6分)(1)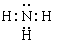 (2)Al(OH)3
(2)Al(OH)3
(3)2Fe2++Cl2=2Fe3++2Cl-?(4)2Al+2NaOH+2H2O=2NaAlO2+3H2↑
本题解析:溶液D能和二氧化锰在加热的条件下生成气体,这说明D应该是浓盐酸,C是氯气。金属Y能和盐酸反应生成溶液I,而I能和氯气继续反应,这说明Y应该是变价的金属,即Y是铁,则I是氯化亚铁,J是氯化铁。B和氯气反应生成氯化氢,所以B是氢气。白色沉淀G能溶于氢氧化钠溶液中,说明G是氢氧化铝,则X是Al,F是氯化铝。F能和E反应生成氢氧化铝,且E是气体,所以E是氨气,则A是氮气。
点评:该题是中等难度的试题,试题综合性强,侧重能力的培养和解题方法的训练,有利于培养学生的逻辑推理能力和创新思维能力。该题的需要学生明确的是化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:困难
3、简答题 下列框图甲所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质.气体B与气体C相遇产生大量的白烟生成E,A是强碱,D的焰色为紫色(部分反应物和生成物及水已略去).

请回答下列问题
(1)写出工业制备B的化学方程式______;
(2)写出常温下,A与丁反应的离子方程式______;
(3)图乙装置为用排空气法收集气体的实验装置
Ⅰ.当从M端通入气体时,可收集的气体有______;
Ⅱ.当从N端通入气体时,可收集的气体有______;(填数字编号)
①气体乙②气体丙③气体丁④气体B⑤气体C
(4)E中所含阳离子的检验方法为(包括实验步骤、现象及结论)______;
(5)A中所含阳离子的检验方法为(包括实验步骤、现象及结论)______.
参考答案:乙、丙、丁为单质,一定条件下乙与B反应得到B,丙、丁在点燃条件下反应得到C,且B与C相遇生成大量白烟生成E,可知B为NH3,C为HCl,则丙为H2,乙为N2,丁应为Cl2,E为NH4Cl,NH4Cl与强碱A反应生成NH3与D,且D的焰色为紫色,含有K元素,故A为KOH、D为KCl,甲是日常生活中常见的金属,能与KOH反应生成氢气,则E为Al,
(1)工业制备氨气的化学方程式为:N2+3H2催化剂.高温高压2NH3,
故答案为:N2+3H2催化剂.高温高压2NH3;
(2)常温下,氯气与KOH反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)图乙装置为用排空气法收集气体的实验装置,
Ⅰ.当从M端通入气体时,应收集密度比空气大的气体,故可以收集C(HCl)、丁(Cl2);
Ⅱ.当从N端通入气体时,应收集密度比空气下的气体,故可收集的气体有:B(NH3)、丙(H2),
N2密度与空气相差不大,不易采取排空气法收集,
故答案为:Ⅰ.③⑤;Ⅱ.②④;
(4)E中所含阳离子为NH4+,检验方法为:取少许与试管中,加入NaOH溶液,加热,用湿润的红色石蕊试纸靠近试管口,试纸变蓝,证明含有NH4+,
故答案为:取少许与试管中,加入NaOH溶液,加热,用湿润的红色石蕊试纸靠近试管口,试纸变蓝,证明含有NH4+;
(5)A中所含阳离子为K+,检验方法为:用洁净的铂丝蘸取A溶液,在无色火焰上灼烧,透过蓝色钴玻璃观察,火焰呈紫色,证明含有K+,
故答案为:用洁净的铂丝蘸取A溶液,在无色火焰上灼烧,透过蓝色钴玻璃观察,火焰呈紫色,证明含有K+.
本题解析:
本题难度:简单
4、简答题 已知A为常见的金属单质,各物质有下图所示的关系:
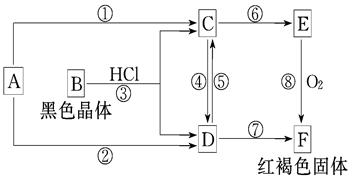
(1)确定A、B、C、D、E、F的化学式:
A为__________,B为__________,C为__________,
D为__________,E为__________,F为__________。
(2)写出以下反应的化学方程式。
④___________________________________________________________________
⑤___________________________________________________________________
⑧___________________________________________________________________
参考答案:(1)A为Fe,B为Fe3O4,C为FeCl2,
D为FeCl3,E为Fe(OH)2,F为Fe(OH)3。
(2)写出以下反应的化学方程式。
④2FeCl2+ Cl2 = 2FeCl3
⑤Fe+2FeCl3 = 3FeCl2
⑧4Fe(OH)2+O2 +2H2O= 4Fe(OH)3
本题解析:推断题要找准题眼,红褐色沉淀,说明F是氢氧化铁,E在氧气条件下转化为氢氧化铁,说明E是氢氧化亚铁,同时也说明A是铁,B是黑色晶体,与盐酸反应生成亚铁和铁离子,说明B是四氧化三铁,C是氯化亚铁,D是氯化铁。
(1)根据上述的推断,可以确定A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为Fe(OH)3。
(2)④是由氯化亚铁转化为氯化铁,一般要加入氧化剂,但是产物只能是氯化铁,则只能加入Cl2。方程式:2FeCl2+ Cl2 = 2FeCl3
⑤是有氯化铁到氯化亚铁,应该加入还原剂,但是不能加铜等,因为产物只有氯化亚铁,则只能选择Fe。方程式:Fe+2FeCl3 = 3FeCl2
⑧氢氧化亚铁在空气中容易转化为氢氧化铁,由白色沉淀迅速转化为灰绿色,最后是红褐色沉淀氢氧化铁,方程式:4Fe(OH)2+O2 +2H2O= 4Fe(OH)3
点评:本题涉及的知识点主要是铁单质及其氧化物,二价铁、三价铁之间的转化。比较简单。
本题难度:一般
5、简答题 有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:①W
X+H2O+CO2②Z+CO2→X+O2↑③Z+H20→Y+O2↑④X+Ca(OH)2→+CaCO3↓
试回答下列问题:
(1)W、X、Y、Z的化学式分别是:W______、X______、Y______、Z______.
(2)以上4个化学反应,属于氧化还原反应的是______(填反应序号),反应中氧化剂是______(写化学式),还原剂是______(写化学式).
(3)若反应④在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:①离子方程式______②化学方程式______.
参考答案:(1)根据框图所示的内容,钠的化合物中,受热能分解生成三种产物的是碳酸氢钠,所以W是碳酸氢钠,碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,所以X是碳酸钠,能和二氧化碳以及水反应生成氧气的是过氧化钠,所以Z是过氧化钠,故答案为:NaHCO3;Na2CO3;NaOH;Na2O2;
(2)以上4个化学反应中,反应2Na2O2+2CO2=2Na2CO3+O2↑和2Na2O2+2H20=4NaOH+O2↑中有元素化合价的变化,属于氧化还原反应,两个反应中化合价变化的均是过氧化钠中的氧元素,所以过氧化钠既是氧化剂又是还原剂,故答案为:②③;Na2O2;Na2O2;
(3)碳酸钠和氢氧化钙反应的离子方程式为:CO32-+Ca2+=CaCO3↓,此外该离子反应还可以表示氯化钙和碳酸钾之间的反应,即K2CO3+CaCl2=CaCO3↓+KCl,
故答案为:CO32-+Ca2+=CaCO3↓,K2CO3+CaCl2来源:91 考试网=CaCO3↓+KCl.
本题解析:
本题难度:简单