微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图表示不同温度(T)和压强(p)对可逆反应2L(g) 2M+2N(g)(吸热反应)的影响,且p2>p1。则图中纵轴表示的意义可能是(?)
2M+2N(g)(吸热反应)的影响,且p2>p1。则图中纵轴表示的意义可能是(?)
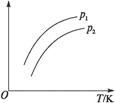
①一定条件下L的转化率②混合气体中M的百分含量③混合气体中L的百分含量④混合气体的平均摩尔质量
A.①②
B.①③
C.②④
D.②
2、选择题 向一容积为5L的恒容密闭容器中充入5molA与8molB,在一定条件下反应:
2A(g) + 3B(g)  xC(g) + yD(g)? (x、y为正整数),反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol/(L·min),D的平衡浓度为0.3mol/L,又知v(B) : v(C)="3" : 2,则下列说法中正确的是
xC(g) + yD(g)? (x、y为正整数),反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol/(L·min),D的平衡浓度为0.3mol/L,又知v(B) : v(C)="3" : 2,则下列说法中正确的是
A.x : y="2" : 1? B.v(A) : v(C)="2" : 1?
C.A的平衡浓度为0.4mol/L? D.A与B的平衡浓度之比为3 : 2
3、填空题 氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义。
(1)合成氨的原理为:N2(g)+3H2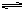 2NH3?△H=" -" 92.4kJ/mol
2NH3?△H=" -" 92.4kJ/mol
①将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,平衡时测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为?。
此温度下该反应的平衡常数K=?。
②欲提高H2的转化率,下列措施可行的是?。
a.向容器中按原比例再充入原料气
b.向容器中再充入惰性气体
c.改变反应的催化剂
d.液化生成物分离出氨
(2)在2L密闭容器中,800℃时反应2NO(g)+O2(g)  ?2NO2(g) △H<0体系中,各成分浓度随时间的变化如图:
?2NO2(g) △H<0体系中,各成分浓度随时间的变化如图:

①用O2表示从0~2s内该反应的平均速率v=___________。
②能说明该反应已经达到平衡状态的是_________。
a.v(NO2)=2v(O2)?
b.容器内压强保持不变?
c.v逆(NO)=2v正(O2)?
d.容器内的密度保持不变
③为使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2气体? b.适当升高温度?
c.增大O2的浓度? d.选择高效的催化剂
(3)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。4CO(g)+2NO2(g) ?4CO2(g)+N2(g)?ΔH=-1 200 kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。
?4CO2(g)+N2(g)?ΔH=-1 200 kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。
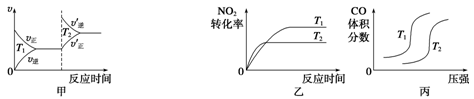
4、填空题 (1)在100 ℃恒温条件下将0.100 mol的N2O4充入体积为1 L的真空密闭容器中,发生反应:N2O4(g) 2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
t/s
c/(mol·L-1)
| 0
| 20
| 40
| 60
| 80
| 100
|
c(N2O4)/(mol·L-1)
| 0.100
| a
| 0.5b
| 0.4b
| ?
| ?
|
c(NO2)/(mol·L-1)
| 0
| 0.060
| b
| c1
| c2
| c3
|
?
请回答下列问题:
①表中a=________,在0~20 s内N2O4的平均反应速率为_______mol·(L·s)-1。
②已知100 ℃时该反应的平衡常数为0.36,则表中b、c1、c2的大小关系为________,c3=________mol·L-1,达到平衡时N2O4的转化率为________________________________。
(2)室温下,把SiO2细粉放入蒸馏水中,不断搅拌,能形成H4SiO4溶液,反应原理如下:
SiO2(s)+2H2O(l)?H4SiO4(aq) ΔH
①写出该反应的化学平衡常数K的表达式:____________________________。
②实际上,在地球的深处,由于压强很大,固体、液体都会受到影响。在一定温度下,在10 000 m以下的地球深处,上述反应的方向是________(填“正方向”、“逆方向”或“不移动”),理由是_______________________________。
5、选择题 下列反应中符合下图图像的是? ( )。

A.N2(g)+3H2(g) 2NH3(g) ΔH=-Q1 kJ·mol-1(Q1>0)
2NH3(g) ΔH=-Q1 kJ·mol-1(Q1>0)
B.2SO3(g) 2SO2(g)+O2(g)ΔH=+Q2 kJ·mol-1(Q2>0)
2SO2(g)+O2(g)ΔH=+Q2 kJ·mol-1(Q2>0)
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH=-Q3 kJ·mol-1(Q3>0)
4NO(g)+6H2O(g)ΔH=-Q3 kJ·mol-1(Q3>0)
D.H2(g)+CO(g) C(s)+H2O(g)ΔH=+Q4 kJ·mol-1(Q4>0)
C(s)+H2O(g)ΔH=+Q4 kJ·mol-1(Q4>0)