微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是? ( )
A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同
B.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同
C.已知:①2H2(g)+O2(g)=2H2O(g) ΔH=-a kJ·mol-1,②2H2(g)+O2(g)=2H2O(l) ΔH=-b kJ·mol-1,则a>b
D.已知:①C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1,②C(s,金刚石)+O2(g)=CO2(g) ΔH=-395.0 kJ·mol-1,则C(s,石墨)=C(s,金刚石) ΔH=+1.5 kJ·mol-1
参考答案:BD
本题解析:浓酸、弱酸等发生酸碱中和时中和热不同;生成液态水放出更多,故-b<-a,即b>a。反应热大小与条件无关,D项利用盖斯定律可求算。
本题难度:一般
2、选择题 在下列各说法中,正确的是?
A.ΔH>0表示放热反应,ΔH<0表示吸热反应
B.热化学方程式中的化学计量数只表示物质的量,可以是分数
C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
参考答案:B
本题解析:A、ΔH>0表示吸热反应,ΔH<0表示放热反应,故A错误;C、中和热是指生成1mol水时放出的热量,故C错误;D、燃烧热是指生成稳定的氧化物即液态水时放出的热量,故D错误;故选B。
本题难度:一般
3、填空题 (12分)氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
①工业合成氨的热化学方程式是_______。
②若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)_______184.4 kJ。
③已知:

1 mol N-H键断裂吸收的能量约等于_______kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
T / ℃
| 165
| 175
| 185
| 195
|
K
| 111.9
| 74.1
| 50.6
| 34.8
|
①焓变ΔH(填“>”、“<”或“=”)_______0。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)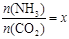 ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是_______。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是_______。
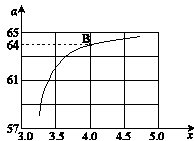
③上图中的B点处,NH3的平衡转化率为_______。
参考答案:(1)①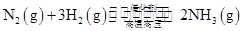 ?
?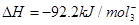 ?
?
② <?③391
(2)① <?②c(NH3)增大,平衡正向移动?③32%
本题解析:(1)合成氨工业中每产生2 mol NH3,放出92.2 kJ热量。根据定量关系可以得到①工业合成氨的热化学方程式是①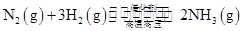 ?
? ;由于该反应是可逆反应所以2 mol N2和6 mol H2完全反应理论上可以放出184.4 kJ热量,但是实际中得到的只能比184.4 kJ少所以②若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q<184.4 kJ。
;由于该反应是可逆反应所以2 mol N2和6 mol H2完全反应理论上可以放出184.4 kJ热量,但是实际中得到的只能比184.4 kJ少所以②若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q<184.4 kJ。
③已知:
 ?
?
所以由反应热的计算公式可得6 mol N-H键能—(1 mol N-N键能+3 mol H-H键能)=92.2kj
所以1 mol N-H键断裂吸收的能量约等于391kJ。
(2)由该反应的平衡常数和温度关系
T / ℃
165
175
185
195
K
111.9
74.1
50.6
34.8
?
可以看到温度越高,平衡向吸热方向移动,K越小,平衡向逆反应方向移动,即逆反应方向就是吸热方向所以正反应方向为放热反应,所以①焓变ΔH<0。
② 2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l)增加NH3的浓度,平衡会向正反应方向移动,所以CO2平衡转化率会增大?
CO(NH2)2 (l) + H2O (l)增加NH3的浓度,平衡会向正反应方向移动,所以CO2平衡转化率会增大?
2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l)
CO(NH2)2 (l) + H2O (l)
起始量物质的量:? 4x? x? 0? 0
变化量物质的量:? 2y? y? y? y
平衡量物质的量:? 4x-2y? x-y? y? y
CO2平衡转化率a=y/x=64%?
所以③上图中的B点处,NH3的平衡转化率=2y/4x=32%
点评:会用化学键计算反应热,会用三行式进行化学平衡的计算,能熟练运用化学平衡常数和温度的变化分析正逆反应的吸放热情况。“三行式”即:第一行表示的是物质开始反应的量,第二行表示的是物质反应的量,第三行表示的是物质反应后的量。
本题难度:一般
4、填空题 氨在工农业生产中应用广泛。在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:
温度/°C
| 200
| 300
| 400
| 500
| 600
|
氨含量/%
| 89.9
| 71.0
| 47.0
| 26.4
| 13.8
|
请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是?。
(2)根据-4,合成氨的热化学方程式是?。

(3)在一定温度下,将2molN2和6molH2通入到体积为1L的密闭容器中,发生反应
N2+3H2? 2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)=?;该温度下的平衡常数K=?(用分数表示);俗使K增大,可以采取的措施是?。
2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)=?;该温度下的平衡常数K=?(用分数表示);俗使K增大,可以采取的措施是?。
(4)从化学平衡移动的角度分析,提高H2转化率可以采取的措施是?(选填序号字母)
a.及时分离出NH3?b.升高温度
c.增大压强? d.使用催化剂
参考答案:
本题解析:略
本题难度:一般
5、选择题 合成氨工业中氢气可由天然气和水反应制备,其主要反应为:
CH4?(g)+ 2H2O?(g) 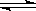 CO2(g)+4H2?(g)
CO2(g)+4H2?(g)
已知,破坏1mol化学键需要吸收的热量如下表所示:
化学键
| C—H
| O—H
| C=O
| H—H
|
吸收热量(kJ/mol)
| 414
| 464
| 803
| 436
|
试通过计算判断,下列有关甲烷转化成氢气过程的能量变化示意图正确的是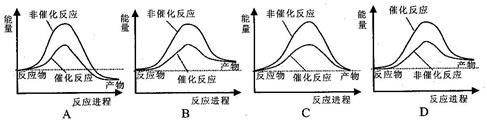
参考答案:B
本题解析:使用催化剂,使物质达到成为活化分子的所需能量降低,也就增多了活化分子数目,使化学反应速率加快,达到化学平衡所需的时间缩短,根据表中数据经过计算产物的总能量高于反应物的总能量,故选B。
点评:本题考查的是影响化学反应速率的因素,以催化剂为例,催化剂会加快化学反应的速率,缩短达到化学平衡所需的时间。
本题难度:简单