微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是? ( )
A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同
B.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同
C.已知:①2H2(g)+O2(g)=2H2O(g) ΔH=-a kJ·mol-1,②2H2(g)+O2(g)=2H2O(l) ΔH=-b kJ·mol-1,则a>b
D.已知:①C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1,②C(s,金刚石)+O2(g)=CO2(g) ΔH=-395.0 kJ·mol-1,则C(s,石墨)=C(s,金刚石) ΔH=+1.5 kJ·mol-1
2、选择题 在下列各说法中,正确的是?
A.ΔH>0表示放热反应,ΔH<0表示吸热反应
B.热化学方程式中的化学计量数只表示物质的量,可以是分数
C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
3、填空题 (12分)氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
①工业合成氨的热化学方程式是_______。
②若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)_______184.4 kJ。
③已知:

1 mol N-H键断裂吸收的能量约等于_______kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
T / ℃
| 165
| 175
| 185
| 195
|
K
| 111.9
| 74.1
| 50.6
| 34.8
|
①焓变ΔH(填“>”、“<”或“=”)_______0。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)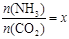 ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是_______。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是_______。
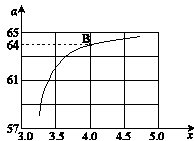
③上图中的B点处,NH3的平衡转化率为_______。
4、填空题 氨在工农业生产中应用广泛。在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:
温度/°C
| 200
| 300
| 400
| 500
| 600
|
氨含量/%
| 89.9
| 71.0
| 47.0
| 26.4
| 13.8
|
请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是?。
(2)根据-4,合成氨的热化学方程式是?。

(3)在一定温度下,将2molN2和6molH2通入到体积为1L的密闭容器中,发生反应
N2+3H2? 2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)=?;该温度下的平衡常数K=?(用分数表示);俗使K增大,可以采取的措施是?。
2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)=?;该温度下的平衡常数K=?(用分数表示);俗使K增大,可以采取的措施是?。
(4)从化学平衡移动的角度分析,提高H2转化率可以采取的措施是?(选填序号字母)
a.及时分离出NH3?b.升高温度
c.增大压强? d.使用催化剂
5、选择题 合成氨工业中氢气可由天然气和水反应制备,其主要反应为:
CH4?(g)+ 2H2O?(g)  CO2(g)+4H2?(g)
CO2(g)+4H2?(g)
已知,破坏1mol化学键需要吸收的热量如下表所示:
化学键
| C—H
| O—H
| C=O
| H—H
|
吸收热量(kJ/mol)
| 414
| 464
| 803
| 436
|
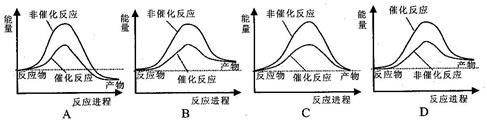
试通过计算判断,下列有关甲烷转化成氢气过程的能量变化示意图正确的是