微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关说法错误的是( )
A.NH3(g)+HCl(g)=NH4Cl(s)低温下能自发进行,说明该反应的△H<O
B.为保护海轮的船壳,常在船壳上镶入锌块
C.纯碱溶于热水中,去污效果增强,说明纯碱的水解是吸热反应
D.反应N2(g)+3H2(g)=2NH3 (g)(△H<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动.
参考答案:A.化学反应能否自发进行,取决于焓变和熵变的综合判据,当△G=△H-T?△S<0时,反应能自发进行. NH3(g)+HC1(g)=NH4C1(S) 低温下能自发进行,△G=△H-T?△S<0,低温T<0,从方程式知:?△S<0,说明△H<0,故A正确;
B.为保护海轮的船壳,常在船壳上镶入锌块,锌块船壳的成分铁和海水构成原电池,锌比铁活泼,锌作原电池的负极,铁作原电池的正极,所以船身被保护,故B正确;
C.纯碱溶于水中,碳酸钠中弱离子碳酸根的水解导致溶液显碱性,碱性溶液能去除油污,纯碱溶于热水中,去污效果增强,说明溶液碱性增强,即碳酸钠水解程度增大,根据化学平衡移动的原理,升高温度,平衡向吸热的方向移动,所以水解是吸热反应,故C正确;
D.反应N2(g)+3H2(g)=2NH3 (g)(△H<0)达平衡后,降低温度,正逆反应的速率均降低,由于该反应正反应为放热反应,所以,降低温度,平衡向正反应方向移动,故D错误;
故选D.
本题解析:
本题难度:简单
2、选择题 下列反应的热效应与其它三项不相同的是
A.铝粉与氧化铁的反应
B.氯化铵与Ba(OH)2·8H2O反应
C.锌片与稀硫酸反应
D.钠与冷水反应
参考答案:B
本题解析:A、B、D项是放热反应,B项是吸热反应。故选B。
点评:本题考查的无机反应中的能量变化,题目难度不大,识记常见反应类型的能量变化是解题的关键。
本题难度:简单
3、选择题 已知断裂1 mol H2和1 mol Cl2中的化学键吸收的能量分别为436 kJ、243 kJ,而由H
原子和Cl原子形成1 mol HCl时释放的能量为431 kJ。则下列热化学方程式中正确的是(?)
A.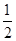 H2(g)+
H2(g)+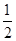 Cl2(g)=HCl(g) ΔH=-183 kJ·mol-1
Cl2(g)=HCl(g) ΔH=-183 kJ·mol-1
B.H2(g)+Cl2(g)=2HCl(g) ΔH=-183 kJ·mol-1
C.HCl(g)=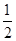 H2(g)+
H2(g)+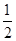 Cl2(g)ΔH=-91.5 kJ·mol-1
Cl2(g)ΔH=-91.5 kJ·mol-1
D.H2(g)+Cl2(g)=2HCl(g) ΔH=+248 kJ·mol-1
参考答案:B
本题解析:H2与Cl2反应的化学方程式为H2(g)+Cl2(g)=2HCl(g),该反应的反应热ΔH=436 kJ·mol-1+243 kJ·mol-1-2×431 kJ·mol-1=-183 kJ·mol-1,故反应的热化学方程式为H2(g)+Cl2(g)=2HCl(g) ΔH=-183 kJ·mol-1,A错误,B正确。HCl分解是吸热反应,C错误。D的计算过程是ΔH=436 kJ·mol-1+243 kJ·mol-1-431 kJ·mol-1=+248 kJ·mol-1,忽视了生成物中HCl为2 mol,因此是错误的。
本题难度:一般
4、选择题 下列反应属于放热反应的是(?)
A.氢气还原氧化铜
B.氯化铵与氢氧化钡晶体混合搅拌
C.碳酸钙高温分解成氧化钙和二氧化碳
D.金属铝片溶于盐酸中
参考答案:D
本题解析:考查常见的放热反应和吸热反应。一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应。所以答案选D。
本题难度:一般
5、选择题 已知化学反应A+B=C+D是放热反应,对该反应的说法正确的是( )
A.A的能量一定高于C的能量
B.B的能量一定高于D的能量
C.反应物A与B的总能量一定低于生成物C与D的总能量
D.反应物A与B的总能量一定高于生成物C与D的总能量
参考答案:A.A和B的总能量一定高于C和D的总能量,A的能量不一定高于C,故A错误;
B.A和B的总能量一定高于C和D的总能量,B的能量不一定高于D,故B错误;
C.化学反应A+B=C+D是放热反应,A和B的总能量一定高于C和D的总能量,故C错误;
D.化学反应A+B=C+D是放热反应,A和B的总能量一定高于C和D的总能量,故D正确.
故选D.
本题解析:
本题难度:简单