微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)(1)将AgNO3溶液分别与HCl、NaCl、KCl溶液混合,均有?产生,它们的离子反应方程式?。
(2)锌粒投入 稀硫酸中,溶液里?离子的量减少,?离子的量增加,?离子的量没有变化.
稀硫酸中,溶液里?离子的量减少,?离子的量增加,?离子的量没有变化.
参考答案:(10分)?⑴白色沉淀? Ag+ + Cl-==AgCl↓
⑵? H+?, Zn2+ ,SO42-(每空2分)
,SO42-(每空2分)
本题解析:略
本题难度:一般
2、填空题 (10分)现有A、B、C、D、E、F六种物质,已知它们的阳离子有:H+、K+、NH4+、Ca2+、Ba2+、Al3+,阴离子有:OH-、Cl-、ClO-、NO3-、CO32-、SO42-。将上述六种物质溶于水均配成0.1mol/L溶液,进行如下实验。
①仅A、C、D三种溶液显酸性,且酸性强弱顺序为A>D>C。
②D与E反应生成白色沉淀,再加入过量的E沉淀量减少但不消失。
③向F中加入A有无色气体生成。
④B的浓溶液与A的浓溶液混合产生有色且有刺激性气体。
(1)根据以上信息,填写下列溶液中溶质的化学式 C ________? E ________?
(2)书写D与过量的E反应的离子方程式。
(3)书写实验④中反应的离子方程式。
(4)向100mLA溶液中慢慢滴加入75mLF溶液和向75mLF溶液中慢慢滴加入100mLA溶液产生的气体体积之比约为____________。
参考答案:(1)? C: NH4NO3? (2分)? E: Ba(OH)2 (2分)
(2)? 2Al3+ + 3SO42- +8OH- + 3Ba2+ = 2AlO2- + 3BaSO4↓+ 4H2O(2分)
(3)? Cl- + ClO- + 2H+ = Cl2↑+ H2O(2分)
(4)? 2:1(2分)
本题解析:(1)有色气体应该是氯气,所以应该是ClO-氧化Cl-生成氯气。又因为仅A、C、D三种溶液显酸性,且酸性强弱顺序为A>D>C,所以A是氯化氢。由于铝离子的水解程度大于NH4+的水解程度,因此D中含有Al3+,C中含有NH4+。向F中加入A有无色气体生成,所以F是碳酸钾。D与E反应生成白色沉淀,再加入过量的E沉淀量减少但不消失,这说明沉淀应该是氢氧化铝和硫酸钡,则E是氢氧化钡,D是硫酸铝。所以B是次氯酸钙,C是硝酸铵。
(2)D与过量的E反应的离子方程式2Al3+ + 3SO42- +8OH- + 3Ba2+ = 2AlO2- + 3BaSO4↓+ 4H2O。
(3)次氯酸钙具有氧化性,能把氯离子氧化生成氯气,反应的方程式是Cl- + ClO- + 2H+ = Cl2↑+ H2O。
(4)由于碳酸钾和盐酸反应是分步进行的,反应的方程式依次是K2CO3+HCl=KHCO3+KCl、KHCO3+HCl=KCl+H2O+CO2↑。盐酸和碳酸钾的物质的量分别是0.01mol和0.0075mol,则向100mLA溶液中慢慢滴加入75mLF溶液,生成0.005molCO2;向75mLF溶液中慢慢滴加入100mLA溶液产生的气体是0.0025mol,所以二者的体积之比是2︰1。
本题难度:一般
3、填空题 (7分)现有含1mol Fe3+和1molAl3+的混合溶液,按下图横坐标依次加入NaOH溶液、盐酸、通入CO2气体,纵坐标为混合沉淀的物质的量。
(1)请画出沉淀的物质的量随反应的变化曲线
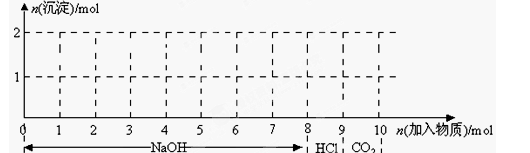
(2)逐步写出:6-7、9-10反应的离子方程式:____________________________________。
参考答案:(1)(4分)
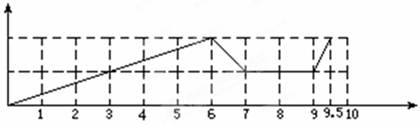
(2)Al(OH)3+OH-=AlO2-+2H2O;
CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-?CO2+ CO32-+H2O=2HCO3-
本题解析:根据试剂可知,反应的方程式先后为Fe3++3OH-=Fe(OH)3、Al3++3OH-=Al(OH)3,此时消耗氢氧化钠是6mol。则继续加入氢氧化钠,氢氧化铝溶解,方程式为Al(OH)3+OH-=AlO2-+2H2O。所以此时加入的2mol氢氧化钠,剩余1mol。因此加入盐酸,首先中和剩余的氢氧化钠,需要1mol盐酸。如果此时通入CO2,则CO2和偏铝酸钠反应生成氢氧化铝沉淀,方程式为CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-,消耗CO2是0.5mol。则另外0.5molCO2和生成的碳酸钠反应,生成碳酸氢钠,方程式为CO2+ CO32-+H2O=2HCO3-。
本题难度:一般
4、选择题 下列离子方程式书写正确的是
A.FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl-
B.实验室制NH3:2N+Ca(OH)2=2NH3↑+Ca2++H2O
C.实验室制CO2:C+2H+=H2O+CO2↑
D.铁与硫酸铜溶液:Fe+Cu2+=Fe2++Cu
参考答案:D
本题解析:分析:A、根据电荷守恒判断,方程式两边电荷不相等;
B、反应物氯化铵和氢氧化钙都是固体,非溶液中的反应,不能写出离子方程式;
C、实验室用碳酸钙正确二氧化碳,碳酸钙是难溶物;
D、铁和硫酸铜反应生成铜和硫酸亚铁.
解答:A、方程式两边电荷不相等,正确应该是:2Fe2++Cl2=2Fe3++2Cl-,故A错误;
B、实验室用氯化铵固体和氢氧化钙固体反应生成氨气,不是在溶液中的反应,无法写出离子方程式,故B错误;
C、实验室用碳酸钙正确二氧化碳,碳酸钙必须写成化学式,正确离子方程式是:CaCO3+2H+=H2O+CO2↑+Ca2+,故C错误;
D、铁和硫酸铜反应的离子方程式是:Fe+Cu2+=Fe2++Cu,故D正确;
故选D.
点评:本题考查了离子方程式的书写判断,注意必须在溶液中的反应才能写出离子方程式,本题难度不大.
本题难度:一般
5、选择题 将等物质的量混合的CH4和Cl2气体经光照后,生成物质的量最多的是
A.CH3Cl
B.CH2Cl2
C.CHCl3
D.HCl
参考答案:D
本题解析:
本题难度:一般