微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中正确的是( )。
A.2 mol CH4的质量和O2的摩尔质量都是32 g
B.1 mol任何气体中都含有相同的原子数
C.0.5 mol NaCl约含有6.02×1023个离子
D.1 mol·L-1 KCl溶液中含有溶质1 mol
参考答案:C
本题解析:O2的摩尔质量为32 g/mol,A项不正确;气体有单原子分子如He,双原子分子如O2,三原子分子如O3,五原子分子如CH4等,B项不正确;D项未指明溶液的体积,不正确。
本题难度:简单
2、选择题 下列有关叙述正确的是:
A.四种基本反应类型中,只有置换反应属于氧化还原反应
B.离子反应的结果是自由移动的离子浓度减小
C.改变影响化学平衡的因素,化学平衡常数可能发生变化
D.Fe(OH)3胶体和饱和FeCl3溶液都呈红褐色,二者可通过丁达尔效应区分
参考答案:C
本题解析:A、有的化合反应和分解反应也是氧化还原反应,错误;B、氧化还原型离子反应的离子浓度不一定减小,错误;C、改变的因素是温度,化学平衡常数发生变化,正确;D、饱和FeCl3溶液为棕黄色,错误。
本题难度:一般
3、填空题 氢化钠(NaH)是一种还原性极强的物质,广泛应用于工业生产。
(1)氢化钠(NaH)中氢元素的化合价为?。
(2)NaH能与水剧烈反应:NaH+H2O= NaOH+H2↑,该反应中的氧化剂是?。如果有12gNaH与水反应,则转移电子的个数为?。
(3)在高温下氢化钠(NaH)可将四氯化钛(TiC14)还原成金属钛,该反应的化学方程式为?。
参考答案:(1)—1(共1分)
(2)H2O? 3.01×1023或0.5NA(共3分;第一空1分,第二空2分)
(3)2NaH+TiCl4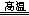 Ti+2NaCl+2HCl↑或4NaH+TiCl4
Ti+2NaCl+2HCl↑或4NaH+TiCl4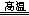 Ti+4NaCl+2H2↑(共2分)
Ti+4NaCl+2H2↑(共2分)
本题解析:(1)化合物中钠元素为+1价,由化合价代数和为0可知,氢元素为—1价;(2)氢元素既由—1价升为0价,又由+1价降为0价,既被氧化又被还原,则 NaH是还原剂,H2O是氧化剂;由m/M可知,n(NaH)=0.5mol;由化合价升降总数为1可知,NaH~e—,则该反应转移0.5mol电子,由n?NA可知,N(e—)=3.01×1023或0.5NA;(3)钛元素由+4价降低到0价,由此推测氢元素由—1价升高为0价或+1价,由化合价升价总数相等、原子守恒可知,2NaH+TiCl4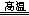 Ti+2NaCl+2HCl↑或4NaH+TiCl4
Ti+2NaCl+2HCl↑或4NaH+TiCl4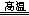 Ti+4NaCl+2H2↑。
Ti+4NaCl+2H2↑。
本题难度:一般
4、简答题 计算题
Fe和CuSO4溶液反应,若反应后溶液的体积为100mL,生成的铜的质量为3.2g.求:
(1)反应消耗的Fe的质量;
(2)反应后溶液中FeSO4的物质的量浓度.
参考答案:反应的方程式为Fe+CuSO4=FeSO4+Cu,3.2g铜的物质的量为:3.2g64g/mol=0.05mol,设消耗的Fe的物质的量为x,
Fe+CuSO4=FeSO4+Cu
1mol? 1mol? 1mol
x? x? 0.05mol
n(Fe)=n(FeSO4)=n(Cu)=0.05mol,
(1)m(Fe)=n?M=0.05mol×56g/mol=2.8g,
答:反应消耗的Fe的质量为2.8g.
(2)c(FeSO4)=0.05mol0.1L=0.5mol/L,
答:反应后溶液中FeSO4的物质的量浓度为0.5mol/L.
本题解析:
本题难度:一般
5、选择题 下列有关氧化还原反应的叙述中,正确的是
A.一定有氧气参加
B.还原剂本身被还原
C.氧化反应先于还原反应发生
D.一定有电子转移(得失或偏移)
参考答案:D
本题解析:氧化还原反应的特征是化合价的升降,实质是单质转移。氧化剂得到电子,化合价降低,本身被还原;还原剂失去电子,化合价升高,本身被氧化,氧化反应和还原反应是同时进行的。
本题难度:简单