微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 NaHSO4在水溶液中能够电离出H+、Na+和SO42-。下列分类中错误的是
A.NaHSO4是盐
B.NaHSO4是酸
C.NaHSO4是钠盐
D.NaHSO4是酸式盐
参考答案:B
本题解析:硫酸氢钠是酸式盐,而不是酸,选项B不正确,其余选项都是正确的,答案选B。
考点:考查物质的有关分类。
点评:在溶液中电离出的阳离子全部是氢离子的化合物是酸,而由酸根离子和金属阳离子(或NH4+)构成的化合物是盐,据此可以进行有关判断。
本题难度:简单
2、选择题 X、Y、Z、W、R五种短周期元素在元素周期表中的位置如图所示,下列有关说法一定正确的是
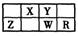
A.非金属性的强弱顺序:Y>W>R
B.X、Y的气态氢化物的稳定性:X>Y
C.原子半径的大小顺序:Z>W>Y
D .W、R的最高价氧化物对应水化物的酸性:W>R
.W、R的最高价氧化物对应水化物的酸性:W>R
参考答案:C
本题解析:略
本题难度:简单
3、选择题 下列各组气态氢化物的稳定性按由强到弱的顺序排列的是
A.HI HCl H2S PH3
B.PH3 H2S HCl HBr
C.HF HCl H2S SiH4
D.NH3 PH3 H2S HCl
参考答案:C
本题解析:A 错误,HI不如HCl稳定
B 错误,HCl最稳定
C 正确,半径越小,其氢化物越稳定
D 错误,P元素的半径最大,所以PH3最不稳定
本题难度:一般
4、填空题 (9分)(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:
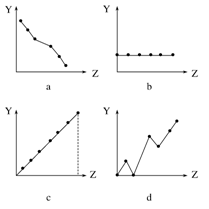
①ⅡA族元素的价电子数?。
②第三周期元素的最高化合价??。
③F-、Na+、Mg2+、Al3+的离子半径?。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y元素原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①N的最高价氧化物对应的水化物的化学式为?。
②X、Y、Z元素符号分别为:X?、Y??、Z?。
③工业上制取单质M的化学方程式为_____________________________ 。
参考答案:(1)①b ②c ③a
(2)①HClO4 ②H、O、Na
③SiO2+2C Si+2CO↑
Si+2CO↑
本题解析:(1)①同主族元素,元素的化合价相同均等于最外层电子数(O、F除外)
②第三周期从左到右,最外层电子数逐渐增多,最高化合价逐渐增大。
③粒子半径大小比较规律:(1)一般来说,电子层数越多,粒子半径越大;(2)电子层数相同,核电荷数越多,半径越小;(3)核电荷数相同,核外电子总数越多,半径越大。
(2)X、Y、Z、M、N对应的元素分别为:H、O、Na、Si、CL
①N的最高价氧化物对应的水化物的化学式为HClO4 ;
②X、Y、Z元素符号分别为:H、O、Na
③工业上制取单质M的化学方程式为SiO2+2C Si+2CO↑
Si+2CO↑
本题难度:简单
5、填空题 (4分)A、B、C、D、E、F、G为由七种短周期元素构成的粒子,它们都有10个电子,其结构特点如下表:
粒子代号
| A
| B
| C
| D
| E
| F
| G
|
原子核数
| 单核
| 单核
| 双核
| 4核
| 单核
| 多核
| 多核
|
电荷数
| 0
| 1+
| 1—
| 0
| 2+
| 1+
| 0
|
其中,B的离子半径大于E的离子半径;C常用作F的检验(加热)。请填写下列空白:
(1)A粒子的结构示意图?。
(2)比较BC和EC2的碱性强弱BC?EC2(填<?、>?、="?" )。
(3)F与C反应的离子方程式? ?
?
参考答案:
(1)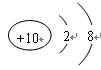 ?(1分)
?(1分)
(2)?>?(1分)
(3)NH4+ +OH― =NH3.H2O?或? NH4+ +OH― NH3↑ ?+ H2O?(2分)
NH3↑ ?+ H2O?(2分)
本题解析:略
本题难度:简单