| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《物质的量》高频考点特训(2017年练习版)(十)
参考答案:C 本题解析:浓盐酸与MnO2发生化学反应,随着反应的进行,盐酸的浓度降低,还原性减弱,稀盐酸与MnO2不反应,以此解答该题。反应的化学方程式为:4HCl(浓)+MnO2 本题难度:简单 4、实验题 某学生在实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制0.1mol/L盐酸溶液250mL,填空并请回答下列问题: 参考答案:(1)2.1;250mL容量瓶、烧杯、玻璃棒、胶头滴管 本题解析: 本题难度:一般 5、选择题 相同质量的SO2和SO3,下列关系正确的是 |
参考答案:C
本题解析:相同质量的SO2和SO3,分子的物质的量之比为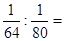 5:4,所以氧原子个数比为5×2: 4×3=5:6,故A错误;分子的物质的量之比为5:4,所以硫元素质量比为5:4,故B错误;氧原子个数比为5:6,故C正确;分子的物质的量之比为5:4,所以硫原子个数比为5:4,故D错误。
5:4,所以氧原子个数比为5×2: 4×3=5:6,故A错误;分子的物质的量之比为5:4,所以硫元素质量比为5:4,故B错误;氧原子个数比为5:6,故C正确;分子的物质的量之比为5:4,所以硫原子个数比为5:4,故D错误。
考点:本题考查物质的量。
本题难度:一般
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学知识点总结《离子共存》.. | ||