D
| 向浓度均为0.1mol·L—1的NaCl和NaI混合溶液中滴加少量的Pb(NO3)2溶液
| 出现黄色沉淀
(PbI2)
| KSP(PbI2)<KSP(PbCl2)
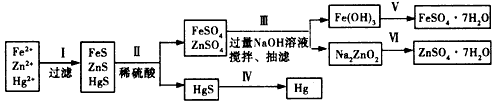
3、实验题 某工厂排出的污水中含有大量的Fe2+、Zn2+、Hg2+三种金属离子。以下是某化学研究性学习小组的同学设计的除去污水中的金属离子,回收绿矾、皓矾(ZnSO4·7H2O)和汞的方案。
【药品】NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉
【实验方案】
【问题探究】
(1)步骤Ⅱ所发生反应的离子方程式为____________________
(2)步骤Ⅲ中的抽滤为减压条件下的过滤,可以加快过滤速度;该步骤涉及反应的离子方程式有
Zn2++4OH-=ZnO22-+2H2O和_______________________
(3)步骤Ⅵ中得到硫酸锌溶液的离子反应方程式为_______________________
(4)欲实现步骤V,所需加入的试剂有____、____, 所涉及的主要操作依次为________________
(5)步骤Ⅳ常用的方法是___________,该步骤是否对环境有影响?_______(填“是”或“否”),如有影响,请你设计一个环境保护方案来实现步骤Ⅳ的反应____________________
4、实验题 工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理
①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸生成铵盐,溶于氢氧化钠溶液生成氨气,请写出AlN与NaOH溶液反应的化学方程式 。?
(2)实验装置(如图所示)
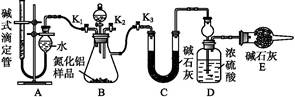
(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为n g,滴定管的读数为a mL。
②称取m g AlN样品置于锥形瓶中;塞好胶塞,关闭活塞 ,打开活塞 ,通过分液漏斗加入过量 (填化学式),与锥形瓶内物质充分反应。?
③待反应进行完全后,关闭活塞 ,打开活塞 ,通过分液漏斗加入过量 (填化学式),与锥形瓶内物质充分反应。?
④ (填入该步应进行的操作)。?
⑤记录滴定管的读数为b mL,称得D装置的质量为p g。
(4)数据分析
①AlN的质量分数为 。?
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”“偏小”或“无影响”)。?
③Al4C3的质量分数为 。(该实验条件下的气体摩尔体积为Vm)?
5、简答题 水蒸气通过灼热的焦炭后,流出气体的主要成分是CO和H2,还有CO2和水蒸气等.请用下图中提供的仪器,选择必要的试剂,设计一个实验,证明上述混合气中有CO和H2.(加热装置和导管等在图中略去)
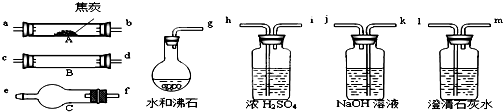
回答下列问题:
(1)盛浓H2SO4的装置用途是______,盛NaOH溶液的装置用途是______.
(2)仪器B中需加入试剂的名称(或化学式)是:______,所发生反应的化学方程式是:______.
(3)仪器C中需加入试剂的名称(或化学式)是:______,其目的是______.
(4)按气流方向连接各仪器,用字母表示接口的连接顺序:______.
(5)能证明混合气中含有CO的实验依据是______.
(6)能证明混合气中含有H2的实验依据是______.
|