微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (12分)某研究性学习小组为测定,13.7g某Na2CO3样品的纯度(其中只含NaHCO3杂质),选用下图所示的仪器装置进行实验(②装置未画全)。试回答有关问题:

(1)请选择适当的仪器,连接装置的正确顺序是_?。
(2)加热时NaHC03分解的化学方程式为?。
(3)完成该实验尚缺的玻璃仪器是?(填名称);产生气体从装置④的?进入,从装置⑤的?进入(填接口序号)。
实验二:测定上述实验完成后剩余固体与盐酸反应产生CO2的体积。
(4)加热后的固体与足量盐酸反应的离子方程式为?。
数据分析及结论:
(5)加入盐酸至无气体产生时,生成CO2体积在标准状况时为2.24L,则Na2CO3样品的纯度为?。
误差分析:
(6)有同学认为实验一⑤中用水会使测量结果产生误差,你认为原因可能是?。
(7)有同学发现在实验—读取CO2体积时,⑥中液体的液面低于⑤中液体的液面,但未做任何处理,则a值?(填“偏大”、“偏小”或“无影响”)。
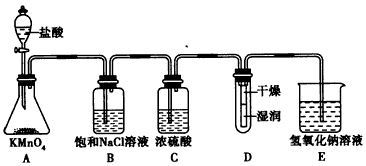
2、实验题 已除去泥沙的粗盐中,仍含有Mg2+、Ca2+和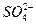 ,请填写下表中的空格,完成将粗盐提纯,得到氯化钠晶体的实验设计。
,请填写下表中的空格,完成将粗盐提纯,得到氯化钠晶体的实验设计。
①
| 溶解
| 将粗盐放入烧杯中,加入适量的蒸馏水,充分搅拌,直至固体全部溶解
|
②
| 沉淀
| 逐渐加入氢氧化钠溶液,直至不再出现沉淀为止
|
③
| ?
| ?
|
④
| ?
| ?
|
⑤
| 过滤
| 安装好过滤器,将④烧杯中的悬浊液沿玻璃棒加入过滤器中过滤
|
⑥
| ?
| ?
|
⑦
| ?
| ?
|
实验目的:粗盐提纯,得到纯净氯化钠晶体
实验用品:(1)药品:粗盐、NaOH溶液、HCl溶液、Na2CO3溶液、BaCl2溶液、pH试纸和蒸馏水。
(2)仪器:略
(不必叙述如何组装实验装置)实验问题讨论
(1)甲同学在多次过滤后,发现烧杯中的滤液仍浑浊,分析他的操作不当的原因可能是:
①_______________________________________________________________________。
②______________________________________________________________________。
(2)乙同学过滤后,滤液是澄清的,当取少量蒸发后的氯化钠晶体溶于水滴加硫酸钠溶液时,却出现白色沉淀。分析乙在实验步骤设计上存在的问题可能是____________________。
3、选择题 通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是(?)
?
| 操作、?现象
| 解释
|
A
| KI淀粉溶液中通入Cl2,溶液变蓝
| Cl2能与淀粉发生显色反应
|
B
| 浓HNO3在光照条件下变黄
| 浓HNO3不稳定,生成有色产物能溶于浓硝酸
|
C
| 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成
| 说明该溶液中含有SO42-
|
D
| 铜片放入浓硫酸中,无明显变化
| 说明铜在冷的浓硫酸中发生钝化
4、实验题 工业上将纯净干燥的氯气通入到0.375 mol/L NaOH溶液中得到漂白水。某同学想在实验室探究Cl2的性质并模拟制备漂白水,下图是部分实验装置。已知KMnO4与盐酸反应可以制取Cl2。
(1)配制物质的量浓度为0.375 mol/L NaOH溶液时,用托盘天平称取所需的NaOH质量为__________。
(2)浓硫酸的作用是______________________。
(3)装置E中发生化学反应方程式为______________________________。
(4)装置B中饱和NaCl溶液的作用是_______________。
(5)实验时装置D中湿润的部分红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因;如需改进,请简述设计方案(若认为合理,则此问可不作答)___________________。
(6)氯元素含量为10%的漂白水溶液355 g,其中含NaClO的物质的量为___________mol。
5、选择题 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验方法不合理的是
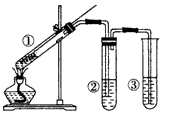
[? ]
A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①中加水,观察颜色
|