D
| 向浓度均为0.1mol·L—1的NaCl和NaI混合溶液中滴加少量的Pb(NO3)2溶液
| 出现黄色沉淀
(PbI2)
| KSP(PbI2)<KSP(PbCl2)
参考答案:AD
本题解析:A、与硝酸银溶液反应产生白色沉淀的不一定氯化钠,也可能是硫酸银或碳酸盐,A正确;B、浓硫酸与固体氯化钠反应制备氯化氢利用的是浓硫酸的难挥发性,与酸性强弱无关系,B不正确;C、能使溴水褪色的无色气体不一定乙烯,也可能是乙炔或二氧化硫等,C不正确;D、向浓度均为0.1mol·L—1的NaCl和NaI混合溶液中滴加少量的Pb(NO3)2溶液出现黄色沉淀,根据沉淀容易转化为更难溶的物质可知KSP(PbI2)<KSP(PbCl2),D正确,答案选AD。
本题难度:一般
3、实验题 某工厂排出的污水中含有大量的Fe2+、Zn2+、Hg2+三种金属离子。以下是某化学研究性学习小组的同学设计的除去污水中的金属离子,回收绿矾、皓矾(ZnSO4·7H2O)和汞的方案。
【药品】NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉
【实验方案】
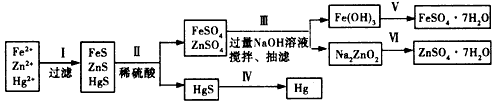
【问题探究】
(1)步骤Ⅱ所发生反应的离子方程式为____________________
(2)步骤Ⅲ中的抽滤为减压条件下的过滤,可以加快过滤速度;该步骤涉及反应的离子方程式有
Zn2++4OH-=ZnO22-+2H2O和_______________________
(3)步骤Ⅵ中得到硫酸锌溶液的离子反应方程式为_______________________
(4)欲实现步骤V,所需加入的试剂有____、____, 所涉及的主要操作依次为________________
(5)步骤Ⅳ常用的方法是___________,该步骤是否对环境有影响?_______(填“是”或“否”),如有影响,请你设计一个环境保护方案来实现步骤Ⅳ的反应____________________
参考答案:(1)FeS+2H+=Fe2++H2S↑、ZnS+2H+=Zn2++H2S↑
(2)4Fe2++O2+8OH-+2H2O=4Fe(OH)3↓
(3)ZnO22-+4H+=Zn2+ +2H2O
(4)稀硫酸;铁粉(过量);过滤、浓缩结晶、过滤
(5)加热;是;在密闭容器中加热HgS
本题解析:
本题难度:一般
4、实验题 工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理
①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸生成铵盐,溶于氢氧化钠溶液生成氨气,请写出AlN与NaOH溶液反应的化学方程式 。?
(2)实验装置(如图所示)
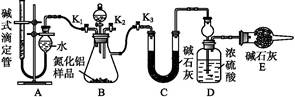
(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为n g,滴定管的读数为a mL。
②称取m g AlN样品置于锥形瓶中;塞好胶塞,关闭活塞 ,打开活塞 ,通过分液漏斗加入过量 (填化学式),与锥形瓶内物质充分反应。?
③待反应进行完全后,关闭活塞 ,打开活塞 ,通过分液漏斗加入过量 (填化学式),与锥形瓶内物质充分反应。?
④ (填入该步应进行的操作)。?
⑤记录滴定管的读数为b mL,称得D装置的质量为p g。
(4)数据分析
①AlN的质量分数为 。?
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”“偏小”或“无影响”)。?
③Al4C3的质量分数为 。(该实验条件下的气体摩尔体积为Vm)?
参考答案:(1)②AlN+NaOH+H2O NaAlO2+NH3↑ NaAlO2+NH3↑
(3)②K2、K3 K1 稀硫酸 ③K1 K3 NaOH ④打开K2,通入空气一段时间
(4)①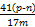 ×100% ②偏小 ③ ×100% ②偏小 ③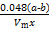 ×100% ×100%
本题解析:(3)A装置是测量CH4的装置、D装置是吸收NH3的装置,从实验装置和实验步骤上看,本实验的原理是用足量硫酸与样品中Al4C3、AlN完全反应,生成甲烷、铵盐,量取生成的甲烷,从而可测得Al4C3的质量分数;用足量NaOH溶液与生成的铵盐反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数;(4)①根据氮原子的守恒,氨气的物质的量等于AlN的物质的量,可求得AlN的质量分数;③Al4C3的物质的量等于甲烷的物质的量的,可求得Al4C3的质量分数
本题难度:困难
5、简答题 水蒸气通过灼热的焦炭后,流出气体的主要成分是CO和H2,还有CO2和水蒸气等.请用下图中提供的仪器,选择必要的试剂,设计一个实验,证明上述混合气中有CO和H2.(加热装置和导管等在图中略去)
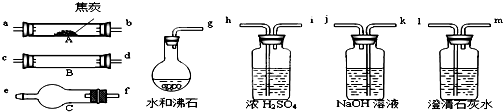
回答下列问题:
(1)盛浓H2SO4的装置用途是______,盛NaOH溶液的装置用途是______.
(2)仪器B中需加入试剂的名称(或化学式)是:______,所发生反应的化学方程式是:______.
(3)仪器C中需加入试剂的名称(或化学式)是:______,其目的是______.
(4)按气流方向连接各仪器,用字母表示接口的连接顺序:______.
(5)能证明混合气中含有CO的实验依据是______.
(6)能证明混合气中含有H2的实验依据是______.
参考答案:(1)浓硫酸可以做干燥剂,盛浓H2SO4的装置用途是将气体干燥,除去水蒸气,检验一氧化碳还原氧化铜的产物二氧化碳之前要先将生成的二氧化碳除去,可以用氢氧化钠来吸收,
故答案为:除去水蒸气;除去CO2;
(2)检验合气体中有CO和H2可用氧化铜,发生反应:CuO+H2?△?.?Cu+H2O、CuO+CO?△?.?Cu+CO2,氢气和一氧化碳还原氧化铜是在大试管中进行的,故答案为:氧化铜(CuO);CuO+H2?△?.?Cu+H2O、CuO+CO?△?.?Cu+CO2;
(3)检验水可用无水硫酸铜,将其装入干燥管中进行检验,
故答案为:无水硫酸铜(CuSO4);检验H2O;?
(4)为了验证混合气中含有CO和H2,实验仪器的连接先后顺序为:除二氧化碳→除掉水分→还原装置→检验水分→检验二氧化碳;除杂质连接仪器的原则是:长进短出;故答案为:g-ab-kj-hi-cd(或dc)-fe-lm;
(5)如果有CO存在,CO和黑色的氧化铜反应生成红色的铜和二氧化碳,原混合气中的CO2已被除去,其中CO与CuO反应生成的CO2使澄清石灰水变浑浊,故答案为:B中黑色的CuO变成红色粉末,最后装置的澄清石灰水变浑浊;
(6)如果有氢气存在,氢气和黑色的氧化铜反应生成红色的铜和水,水和白色的无水硫酸铜反应生成蓝色的硫酸铜晶体,故答案为:B中黑色的CuO变成红色粉末,C中无水硫酸铜由白色变为蓝色.
本题解析:
本题难度:一般
|