|
|
|
高中化学知识点总结《化学平衡》考点巩固(2017年最新版)(二)
2017-03-02 22:59:11
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)
(1)与OH-电子数和质子数均相同的单核微粒的离子结构示意图为____________
(2)250C时,2.3 g酒精在血液中被氧气完全氧化放出66.8 kJ热量,该反应的热化学方程式为________________(3)汽车安全气囊中含MYn和红棕色金属氧化 物。M、Y为短周期元素,其最外层电子数之和等于氧原子的最外层电子数,且可发生下图的转化。

①写出元素符号:M______;Y_______.
②在2L密闭容器中,起始投入2 mol Y2和3.5 mol H2发生反应II,测得平衡时的数据如表。

若该反应ΔH <0,则T1______T2(填“ >”、“ <”或“=”);在温度T2下,若经过10 min反应达到平衡,则平均速率v(YH3)= ______,平衡常数为______ (保留两位有效数字)
③反应III的化学方程式为___________________。
参考答案:23.(14分)(1)
(2)C2H5OH(l)+3O2(g) = 2CO2(g)+3H2O(l) △H =-1336 kJ · mol
本题解析:
本题难度:一般
2、选择题 在一恒容密闭烧瓶中,25℃时存在平衡:2NO2(g)  N2O4(g) △H<0。将烧瓶置于100℃的水中,则下列物理量中不会改变的是 N2O4(g) △H<0。将烧瓶置于100℃的水中,则下列物理量中不会改变的是
A.颜色
B.密度
C.N2O4的浓度
D.压强
|
参考答案:B
本题解析:可逆反应2NO2?N2O4,正反应为放热反应,升高温度,化学平衡向着逆反应方向移动,A、二氧化氮的浓度增大,颜色加深,A不符合;B、反应混合物都是气体,根据质量守恒定律,混合气体总的质量不变,容器的容积不变,根据ρ=mV可知,混合气体的密度不变,B符合;C、升高温度,化学平衡向着逆反应方向移动,二氧化氮气体浓度增大,N2O4的浓度减小,C不符合;D、升高温度,化学平衡向左移动,混合气体总的物质的量增大、混合气体的温度升高,容器的容积不变,根据pV=nRT可知,容器内压强增大,D不符合;答案选B。
考点:考查化学平衡的影响因素。
本题难度:一般
3、计算题 在密闭容器中充入A(g)和B(g),它们的初始浓度均为2mol?L
参考答案:
本题解析:
本题难度:一般
4、填空题 设反应①Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1,反应②Fe(s)+H2O(g) FeO(s)+CO(g)的平衡常数为K1,反应②Fe(s)+H2O(g) FeO(s)+H2(g)的平衡常数为K2。在不同温度下,K1、K2的值如下 FeO(s)+H2(g)的平衡常数为K2。在不同温度下,K1、K2的值如下
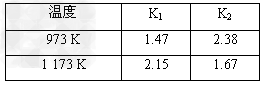
(1)从上表可以推断:反应①是________(填“吸”、“放”)热反应。
(2)现有反应③CO2(g)+H2(g)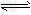 CO(g)+H2O(g),写出该反应的平衡常数K3的数学表达式:K3=________。 CO(g)+H2O(g),写出该反应的平衡常数K3的数学表达式:K3=________。
(3)根据反应①与②,可推导出K1、K2与K3之间的关系式。据此关系式及上表数据,也能推断出反应③是“吸热”还是“放热”反应。问:要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有________(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度 D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(4)图1、2表示反应③在t1时刻达到平衡、在t2时刻因改变某个条件而发生变化的情况:

①图1中t2时刻发生改变的条件是?___________________________________。
②图2中t2时刻发生改变的条件是?_____________________。
参考答案:(1)吸
(2)“略”
(3)DF
(4)①加入催化剂或增大体系的压强;②降低温度或增加水蒸气的量或减少氢气的量
本题解析:
本题难度:一般
5、填空题 甲醇是重要的化工原料和清洁液体燃料。工业上可利用CO或CO2来生产甲醇。甲醇制
备的相关信息如下表:
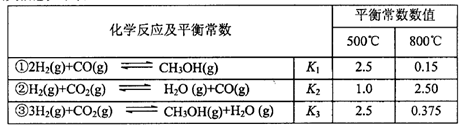
(1)反应②是____反应(选填“吸热”“放热”)。
(2)据上表信息推导出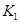 、 、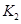 与 与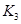 之间的关系, 之间的关系,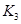 =______用 =______用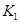 、 、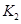 表示)。500℃时测得反应③在某时刻, 表示)。500℃时测得反应③在某时刻,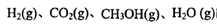 的浓度(mol/L)分别为0 8、0.1、0 3、0 15,此时 的浓度(mol/L)分别为0 8、0.1、0 3、0 15,此时 (选填“>”“<”“=”)。 (选填“>”“<”“=”)。
(3)若某温度下反应①从开始到平衡CO和CH3OH的浓度变化如图一所示,则用H2浓度变化表示此段时间内该反应的平均速.v(H2)=?若某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图二所示,则平衡状态由A变到B时,平衡常数 (选填“>”“<”“=”)。 (选填“>”“<”“=”)。

(4)一定温度下,在体积固定的密闭容器中发生反应②,可判断该反应已经达到平衡的是____。(用相应字母表示)
A.容器中总压强不变
B.混台气体的平均摩尔质量也始终保持不变,
C.混合气体的密度不变
D.CO2(g)或CO(g)的浓度不变
|
(5)一定条件下甲醇与一氧化碳反应可合成醋酸。室温下,将a mol/L醋酸溶液与bmol/LNaOH溶液等体积混合。若溶液显中性,则a_________b(选填“>”“<”“=”)。若c(Na+)<c(CH3COO-),则溶液显____性(选填“酸”“碱…中”)。
参考答案:
(1) 吸热? (1分)
(2) K1K2?(2分)? >?(2分)
(3) 0.15mol/(L·min)? (2分)? =? (2分)
(4) D? (1分)?(5)>? (2分)?酸? (2分)
本题解析:(1)反应②的K随着温度的升高而增大,故反应②为吸热反应(2)①+②=③,故K3=K1K2;500℃时反应③在某时刻的Q=0.3×0.15÷(0.83×0.1)=0.88<2.5,平衡正向移动,故V正>V逆;(3)v(H2)=2v(CO)=2×(1.00-0.25)÷10mol·L-1·min-1="0.15" mol·L-1·min-1;平衡常数是温度函数,温度不变,K不变,故K(A)=K(B)(4)反应②是一个反应前后体积不变的反应,故压强不能作为判断是否平衡的标志,混台气体的平均摩尔质量也始终保持不变,由于在体积固定的密闭容器中发生反应②,所以混合气体的密度也不变,故选D。(5)醋酸与氢氧化钠等体积中和,若溶液显中性,说明醋酸过量,即a>b;若c(Na+)<c(CH3COO-) ,则c(H+)>c(OH-)即溶液显酸性
本题难度:困难