微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)亚硫酸钠中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、Na2S溶液、
Na2SO3溶液、稀硫酸、NaOH溶液、氨水。
(1)要证明Na2SO3具有还原性,应选用的试剂有________,看到的现象是 ________,反应的方程式为___________________________
(2)实验室制取氯气的化学方程式:?括号中为杂质,填上除杂试剂:Cl2中(HCl) ?。??
(3)由SiO2制取粗硅的化学方程式?
(4)将ag由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为??ag (> ;< ;=)
参考答案:(1)Na2SO3?溴水?溴水褪色 Na2SO3+ Br2 + H2O = Na2SO4+2HBr?
Na2SO3 + Br2 + H2O =H2SO4 + 2NaBr?(2) MnO2 +4HCl(浓)  MnCI2 + Cl2↑+2H2O?饱和食盐水(3)SiO2 + 2C
MnCI2 + Cl2↑+2H2O?饱和食盐水(3)SiO2 + 2C Si + 2CO ?(4) =
Si + 2CO ?(4) =
本题解析:(1)要证明Na2SO3具有还原性,应选用的试剂是Na2SO3和有强的氧化性的物质是溴水。发生的反应是:Na2SO3+ Br2 + H2O = Na2SO4+2HBr。现象为溴水褪色。(2) 实验室制取氯气的化学方程式:MnO2 +4HCl(浓)  MnCI2 + Cl2↑+2H2O。由于是用的浓盐酸反应制取的。浓盐酸有挥发性,所以在制取的Cl2中含有杂质HCl气体。除去的方法是把混合气体通入到饱和NaCl水中,HCl极容易溶解在水中而得到除去,发生反应Cl2+H2O
MnCI2 + Cl2↑+2H2O。由于是用的浓盐酸反应制取的。浓盐酸有挥发性,所以在制取的Cl2中含有杂质HCl气体。除去的方法是把混合气体通入到饱和NaCl水中,HCl极容易溶解在水中而得到除去,发生反应Cl2+H2O H++Cl-+HClO.因为水中含有NaCl、及HCl电离产生的Cl-,增大了生成物的浓度,使化学平衡逆向移动,又减少了Cl2的溶解、反应消耗。达到了既除去杂质也不减少被提纯的物质本身。(3)由SiO2制取粗硅的化学方程式为SiO2 + 2C
H++Cl-+HClO.因为水中含有NaCl、及HCl电离产生的Cl-,增大了生成物的浓度,使化学平衡逆向移动,又减少了Cl2的溶解、反应消耗。达到了既除去杂质也不减少被提纯的物质本身。(3)由SiO2制取粗硅的化学方程式为SiO2 + 2C Si + 2CO。(4)2H2+O2
Si + 2CO。(4)2H2+O2 2H2O;2Na2O2+2H2O=4NaOH+O2↑;2CO+O2
2H2O;2Na2O2+2H2O=4NaOH+O2↑;2CO+O2 2CO2。2Na2O2+2CO2=2Na2CO3+O2。可见:H2、CO燃烧消耗的氧气与反应产物与Na2O2反应放出的氧气质量相等。即固体增加的质量就是反应物H2、CO的质量和。若混合气体的质量为ag,则燃烧产物与过氧化钠反应后固体质量增加的也是ag.2SO3、Na2O2的化学性质及Si 、Cl2的制法杂质的除去等知识。
2CO2。2Na2O2+2CO2=2Na2CO3+O2。可见:H2、CO燃烧消耗的氧气与反应产物与Na2O2反应放出的氧气质量相等。即固体增加的质量就是反应物H2、CO的质量和。若混合气体的质量为ag,则燃烧产物与过氧化钠反应后固体质量增加的也是ag.2SO3、Na2O2的化学性质及Si 、Cl2的制法杂质的除去等知识。
本题难度:一般
2、选择题 下列有关说法中正确的是( ? )
A.16O、17O、18O互为同位素
B.金刚石和石墨互为同分异构体
C.CH3CH2CH2CH3和CH3CH(CH3)CH2CH3互为同分异构体
D.甲醇(CH3OH)、乙二醇( )、丙三醇(
)、丙三醇(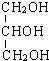 )互为同系物
)互为同系物
参考答案:A
本题解析:
本题难度:一般
3、选择题 关于元素周期表的下列叙述,不正确的是
[? ]
A.元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要里程碑之一
B.元素周期表中,总共有18个纵行,16个族,过渡元素都为副族元素
C.在周期表中,第ⅡA族元素都为金属元素
D.X3+的核外电子数目为10,则X在第三周期第ⅢA族
参考答案:B
本题解析:
本题难度:简单
4、选择题 元素X的原子核外M电子层有3个电子,元素Y2-离子核外共有18个电子,则这两种元素可形成的化合物为
[? ]
A.XY2
B.X2Y
C.X2Y3
D.X3Y2
参考答案:C
本题解析:
本题难度:一般
5、选择题 根据已知条件,对物质的性质强弱判断不正确的是( )
A.已知2C+SiO2
Si+2CO↑,说明非金属性:碳>硅
B.已知相同条件下气态氢化物的稳定性.HA>HB,说明还原性:A-<B-
C.已知?

,说明酸性:碳酸>苯酚
D.已知物质的量浓度相同的MCl和NCl两种溶液中c(M+)>c(N+),说明碱性:MOH>NOH
参考答案:A
本题解析:
本题难度:简单