微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 “酒是陈的香”,就是因为酒在储存过程中生成了有香 味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。
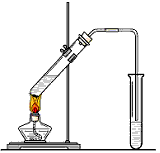
回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式______________________
(2)饱和碳酸钠溶液的主要作用是____________、____________、____________。
(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是______________。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是____________________。
(5)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是____________________。
参考答案:(1)CH3COOH+CH3CH2OH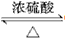 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
(2)中和挥发出来的乙酸;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度
(3)防倒吸
(4)分液
(5)防止大试管中液体暴沸而冲出导管
本题解析:
本题难度:一般
2、实验题 铁黄是一种重要的颜料,化学式为Fe2O3·xH2O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等)和黄铁矿粉(主要成分为FeS2)制备铁黄的流程如下
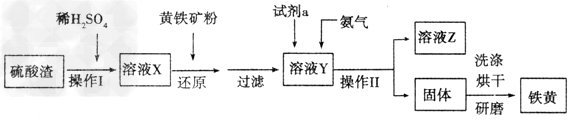
(1)操作Ⅰ与操作Ⅱ中都用到玻璃棒,玻璃棒在两种操作中的作用分别是__________、____________。
(2)试剂a最好选用_____________(供选择使用的有:铝粉、空气、浓HNO3);其作用是____________________。
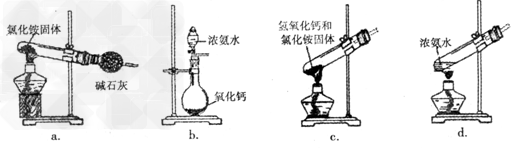
(3)上述步骤中需用到氨气。下列装置可用于实验室制氨气的是________(填序号)。
(4)检验溶液Z中含有 的方法是______________。
的方法是______________。
(5)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如下图所示。
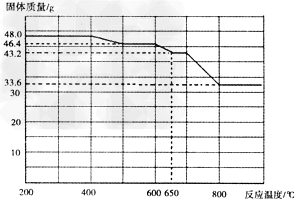
根据图象推断670℃时Fe2O3还原产物的化学式为___________?,并设计一个简单的实验,证明该还原产物的成分(简述实验操作、现象和结论)
仪器自选。可供选择的试剂:稀H2SO4、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。
____________________________________________
参考答案:(1)搅拌加速溶解(或搅拌加速反应);引流
(2)空气;作氧化剂,将Fe2+氧化为Fe3+(或氧化剂、氧化Fe2+或将Fe2+转化为Fe3+)
(3)bd
(4)取少量溶液Z置于试管中,滴加过量浓NaOH溶液并微热,将湿润的红色石蕊试纸靠近试管口,试纸变蓝色,证明含有NH4+
(5)FeO;取少量还原产物置于试管中,加入过量稀硫酸(或稀盐酸),固体完全溶解且无气泡产生,再向其中滴加KSCN溶液,溶液不变色,最后滴加H2O2溶液,溶液变红色,证明还原产物为FeO
本题解析:
本题难度:一般
3、实验题 聚合硫酸铁又称聚铁,化学式为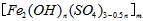 ,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下
,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下
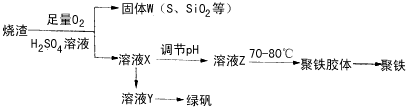
(1)验证固体W焙烧后产生的气体含有SO2的方法是_________________。
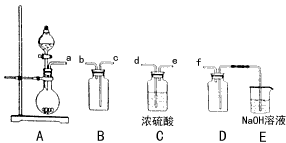
(2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,
①按气流方向连接各仪器接口顺序为a→_____→______→______→______→f
②装置D的作用是_________________,装置E中NaOH溶液的作用是______。
(3)制备绿矾时,向溶液X中加入过量______________,充分反应后,经_______操作得到溶液Y,再经浓缩,结晶等步骤得到绿矾。
(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为_____________。若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏__________。
参考答案:(1)将气体通入品红溶液中,如品红褪色,加热后又变红,证明有SO2。
(2)①d、e、b、c;②安全瓶,防止倒吸;尾气处理,防止污染
(3)铁粉;过滤
(4)将试纸放到表面皿上,用玻璃棒蘸取溶液,点到试纸的中央,然后跟标准比色卡对比;低
本题解析:
本题难度:困难
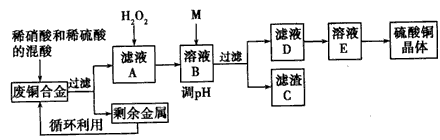
4、实验题 实验室利用废铜合金(含少量铁和铝)来制取硫酸铜晶体(CuSO4·xH2O),方案如下:
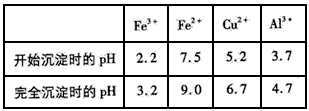
金属离子生成氢氧化物沉淀的pH可参考下列数据:
请回答:
(1)写出加入混酸后,合金中铜溶解的离平方程式__________ 。
(2)若溶解合金时加入的混酸由2 L3 mol/L硫酸和1L 2 mol/L硝酸混合而成,则反应后生成标准状况下的NO的体积最多为____________。
(3)加入H2O2的目的是____________。
(4)为保证产品的纯度,M物质最好选用___________ (填字母), 调节pH的范围为____。
a. Cu(OH)2
b. H2SO4
c. NH3·H2O
d. Na2CO3
(5)滤液D中加入硫酸的目的为____________ 。
(6)从溶液E制得CuSO4·xH2O晶体所需要的步骤为_______ 、_________、过滤、干燥。
(7)要测定所得硫酸铜晶体CuSO4·xH2O中x的值,下列说法不正确的是____(填字母)。
a.称量操作至少要进行4次
b.需将坩埚放在石棉网上进行加热
c. 加热后,将坩埚放在石棉网上冷却,会使所测x的值偏小
参考答案:(1)3Cu+2NO3-+8H+=3Cu2+ +2NO↑ +4H2O
(2)44.8
(3)将Fe2+氧化为Fe3+
(4)a ;4.7≤pH<5.2
(5)抑制Cu2+的水解
(6)加热蒸发; 冷却结晶
(7)b
本题解析:
本题难度:困难
5、选择题 用含有少量镁的铝片制取纯净的Al(OH)3,可能有的步骤为:① 加盐酸溶解;② 加苛性钠溶液;③ 过滤;④ 通入过量CO2;⑤ 加过量纯碱溶液,实验操作最合理的组合及顺序是
[? ]
A.①⑤④③
B.②③④③
C.②③⑤③
D.①⑤③
参考答案:B
本题解析:
本题难度:一般