微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~140℃与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如下表
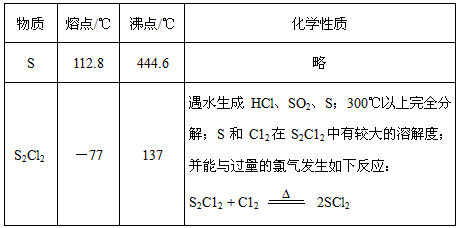
设计实验装置图如下:

⑴上图中有一处重大缺陷,请你提出改进意见: _________________________。利用改进后的正确装置进行实验,请回答下列问题:
⑵E中反应的化学方程式:________________________。
⑶C中的试剂是_______________________。长导管F有导气、_______________的作用。
⑷实验开始后,对于B、E两处酒精灯的点燃顺序是___________;
a.先B后E b.先E后B c.一起点燃
你选择的理由是___________。
⑸如果在加热E时温度过高,对实验结果的影响是__________________________。
⑹S2Cl2粗品中可能混有的杂质是(填写两种)______________、________________,为了提高S2Cl2的纯度,关键的操作是控制好温度和_________________。
2、实验题 氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。

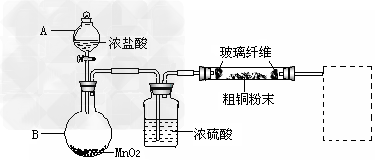
(1)实验室采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去)。
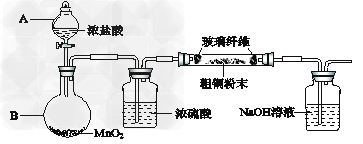
①仪器A的名称是_______________。
②?装置B中发生反应的离子方程是_____________?。
③?有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”)____________。
(2)试剂X用于调节pH以除去杂质,?X可选用下列试剂中的(填序号)__________。
a.NaOH?b.NH3·H2O?c.CuO?d.Cu2(OH)?2CO3?e.CuSO4
(3)在溶液2转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为绿色。小组同学欲探究其原因。
已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+ (aq)?+4Cl-(aq)?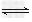 CuCl42-(aq)?+4H2O(l)?
CuCl42-(aq)?+4H2O(l)?
蓝色 黄色
①?上述反应的化学平衡常数表达式是K=?_____________。若增大氯离子浓度,K值(填“增大”、“减小”或“不变”)?。
②?取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是(填序号)_____________。
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失
3、实验题 某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。
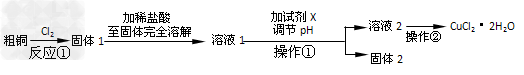
(1)实验室采用如下图所示的装置,可将反应①粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去)。
①?仪器A的名称是_________________。
②?连接好装置后,加入药品前,应该进行的实验操作是_______________。
③?装置B中发生反应的离子方程式是______________。
④?有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”)________________。 ?
⑤?虚线内缺少实验装置,请你画出装置图,标明药品名称。
(2)试剂X用于调节pH以除去杂质,?X可选用下列试剂中的(填序号)___________。
a.NaOH?b.NH3·H2O?c.CuO?d.Cu2(OH)2CO3?e.CuSO4
操作①的名称是______________。
(3)在溶液2转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为绿色。小组同学欲探究其原因。已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+ (aq)?+4Cl-(aq)?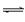 CuCl42-(aq)?+4H2O(l)
CuCl42-(aq)?+4H2O(l)
? 蓝色?黄色
取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是(填序号)_____________。
a.将Y稀释,发现溶液呈蓝色 b.在Y中加入CuCl2晶体,溶液变为绿色 c.在Y中加入NaCl固体,溶液变为绿色 d.取Y进行电解,溶液颜色最终消失 ?
(4)操作②需在氯化氢气流中经过加热浓缩、__________、过滤、洗涤、干燥。
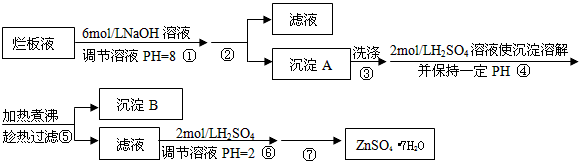
4、实验题 “烂板液”是制印刷锌板时,用稀HNO3腐蚀锌板后得到的废液,主要含Zn(NO3)2和由自来水带进的
Cl-、Fe3+等杂质离子。在实验室中由“烂板液”制取ZnSO4·7H2O的过程如下
已知有关金属离子形成氢氧化物沉淀时的PH见下表
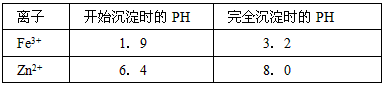
(1)第①反应是使Zn2+、Fe3+沉淀,检验Fe3+是否沉淀完全的操作是____________________________。
(2)第②步操作中需要的玻璃仪器有_______________。
(3)第④步中PH应保持在_______________范围内。
(4)第⑥步调节溶液PH=2的目的是______________________________。
(5)操作⑦包含3个基本实验操作,它们是蒸发浓缩、_______________和过滤。
5、实验题 根据硫化氢气体的实验室制法和性质完成下列填空。
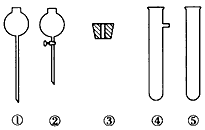
(1)若用启普发生器制取硫化氢气体,则制取气体的原料可选用_____________。
a、稀硫酸与硫化亚铁 b、稀硝酸与硫化亚铁 c、稀硫酸与硫化钠 d、稀盐酸与硫化亚铁
(2)现要组装一套可以控制硫化氢气体产生速率的装置,请在下图中选择合适的仪器________________(填编号)。
(3)如图,在一个充满氧气的集气瓶中加入少量品红稀溶液,点燃硫化氢气体。在火焰自动熄灭后,停止通入气体,瓶内可观察到的现象是_________________________。
(4)在上述集气瓶中继续通入硫化氢气体,振荡,发生反应的化学方程式为:____________________。反应过程中,溶液的pH__________ (填“变大”、“变小”或“不变”)。
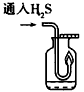
(5)点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置。下图的装置能起到此作用的是___________________________
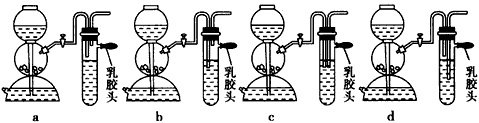
(6)已知硫化氧气体在空气中的体积分数为4.3%~45.5%时会发生爆炸。当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是__________________