微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 工业上常以废铜屑(含少量铁、油污)制取胆矾(CuSO4·5H2O),流程如下图(已知Ksp[Cu(OH)2] =
2.2×10 -20,Ksp[Fe(OH)2]=8.0×10 -16,Ksp[Fe(OH)3]=4.0×10 -38),请回答:

(1)步骤①中纯碱的作用是____。
(2)步骤②中稀硫酸要过量,否则制得的胆矾晶体中会含杂质____(填化学式)。
(3)步骤③中A试剂可以是____,作用是____。
参考答案:(1)洗去铜屑表面的油污
(2)FeSO4·7H2O
(3) CuO、 Cu(OH)2、CuCO3等; 调节溶液pH,使Fe3+形成Fe(OH)3沉淀析出;
本题解析:
本题难度:一般
2、选择题 下列说法错误的是
[?]
A.蔗糖、硫酸钡和碳酸分别属于非电解质、强电解质和弱电解质?
B.将FeCl3固体溶解于沸水中可制得Fe(OH)3胶体 ?
C.常温常压下,28g?N2和CO的混合气体中,原子总数一定是2NA?
D.硫酸、熟石灰、纯碱和生石灰分别属于酸、碱、盐和氧化物
参考答案:B
本题解析:
本题难度:简单
3、选择题 根据“绿色化学”的思想,某化学家设计了下列化学反应步骤:?
①CaBr2+H2O CaO+2HBr
CaO+2HBr
②2HBr+Hg HgBr2+H2↑
HgBr2+H2↑
③HgBr2+CaO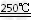 HgO+CaBr2
HgO+CaBr2
④2HgO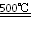 2Hg+O2↑
2Hg+O2↑
该方案的目的是为了制备
[? ]
A.HBr?
B.CaO?
C.H2?
D.Hg
参考答案:C
本题解析:
本题难度:简单
4、实验题 用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作
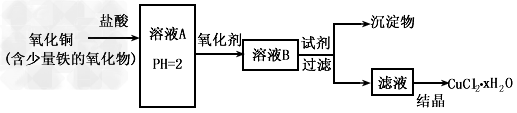
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)溶液A中的金属离子有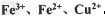 。检验溶液A中含有Fe2+的最佳试剂为_______(填编号,下同)
。检验溶液A中含有Fe2+的最佳试剂为_______(填编号,下同)
①?KMnO4?②(NH4)2S?③?NaOH?④?KSCN
(2)氧化剂可选用_______
① Cl2?②?KMnO4?③?HNO3?④?H2O2
(3)要得到较纯的产品,试剂可选用_______
①?NaOH?②?FeO?③?CuO?④?Cu2(OH)2CO3
(4)从滤液经过结晶得到氯化铜晶体的方法是(按实验先后顺序选填编号)_______
①过滤?②蒸发浓缩?③蒸发至干?④冷却
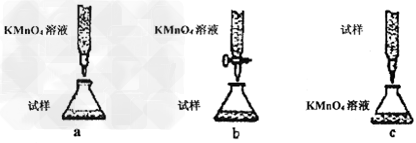
(5)欲测定溶液A中的Fe2+的浓度,实验前,首先要配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需要的仪器是_______ 下列滴定方式中,最合理的是_______?(夹持部分略去)(填字母序号)
(6)为了测定制得的氯化铜晶体(CuCl2·xH2O)中X的值,某兴趣小组设计了两种实验方案:
方案一:称取mg晶体灼烧至质量不再减轻为止,冷却、称量所得固体无水CuCl2的质量为n1?g
方案二:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得固体的质量为n2g。
试评价上述两种实验方案:其中正确的方案是_______,据此计算得X=_______?(用含m、n1或n2的代数式表示)。
参考答案:(1)①?
(2)①④?
(3)③④?
(4)②④①?
(5)250mL容量瓶;b?
(6)二;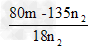
本题解析:
本题难度:一般
5、实验题 纳米碳酸钙广泛应用 于橡胶,塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业。在浓
CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。某校学生实验小组设计如图所示装置,制取该产品。D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
Ⅰ.可选用的药品有:a.石灰石 b.饱和氯化钙溶液 c.6 mol/L盐酸 d.氯化铵 e.氢氧化钙。

(1)A中制备气体时,所需药品是(选填字母序号)________;
(2)B中盛有饱和碳酸氢钠溶液,其作用是________________;
(3)写出制取氨气的化学方程式:____________________;
(4)在实验过程中,向C中通入气体式有先后顺序的,应先通入气体的化学式:___________________;
(5)检验D出口处是否有氨气逸出的方法是________________;
(6)写出制纳米级碳酸钙的化学方程式:____________________;
(7)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级_______________
(8)若实验过程中有氨气逸出,应选用下列____装置回收(填代号)。

Ⅱ.经分析在上述氯化铵样品中含有杂质碳酸氢钠。为了测定氯化铵的质量分数,该学生实验小组又设计了如下实验流程
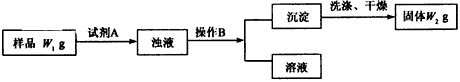
试回答:
(9)所加试剂A的化学式为________,检验所加试剂A已经过量的方法是____________。
(10)B操作方法是________,洗涤沉淀的方法是________。
(11)样品中氯化铵的质量分数为________。
参考答案:(1)ac
(2)除去CO2中的HCl
(3)2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑
CaCl2+2H2O+2NH3↑
(4)NH3
(5)将湿润的红色石蕊试纸放在D出口处,若试纸变蓝,则证明有氨气逸出,若试纸不变蓝,则证明没有氨气逸出(或用蘸有浓盐酸的玻璃棒靠近D出口处,若有白烟,则证明氨气逸出;若没有白烟,则证明没有氨气逸出)
(6)CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl
(7)取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级,否则不是
(8)b
(9)Ca(OH)2或Ba(OH)2;向清液中继续滴加A溶液,若不再产生沉淀,则表明A试剂已过量
(10)过滤;向沉淀中继续加蒸馏水,静置流下,重复两次即可 (11)
本题解析:
本题难度:困难