微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 以下物质中是非电解质的是(? )
①SO2,②HCN,③BaSO4,④Cl2,⑤蔗糖,⑥NaHCO3
A.只有④⑤
B.只有①③
C.只有①⑤
D.只有③④
参考答案:C
本题解析:②③⑥分别属于酸,盐类,是电解质。①⑤是非电解质。④是单质,不属于电解质,也不属于非电解质。所以答案选C
本题难度:简单
2、选择题 经测定某溶液中离子只有Na+、CH3COO-、H+、OH-四种,且离子浓度大小的排列顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-).其可能的情形是( ? )
A.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B.在上述溶液中加入适量NaOH,可能使溶液中离子浓度大小改变为:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.0.1mol/L的CH3COOH溶液与0.2mol/L的NaOH溶液等体积混合
D.该溶液由0.1mol/L的CH3COOH溶液与等物质的量浓度等体积的NaOH溶液混合而成
参考答案:A
本题解析:
本题难度:简单
3、填空题 (1)在25°C时,已知0.1mol/LHCN溶液的PH=4,0.1mol/LNaCN溶液的pH=12.现将0.2mol/L的HCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液中各种离子的浓度有大到小的关系为______.
(2)常温下,将0.01molNH4Cl和0.002molNaOH溶于水,配制成0.5L混合溶液.试回答(填写数据):
①溶液中c(NH
)+c(NH3?H2O)一定等于______
②溶液中n(OH-)+n(Cl-)-n(NH+4)=______.
参考答案:(1)已知,0.1mol/LHCN溶液的PH=4,0.1mol/LNaCN溶液的pH=12说明CN-的水解程度大于HCN的电离程度;将0.2mol?L-1HCN溶液和0.1mol?L-1的NaOH溶液等体积混合后,溶液溶质为HCN和NaCN,二者浓度相等,溶液显碱性,说明CN-水解程度大于HCN电离程度,溶液中离子浓度大小关系为:C(Na+)>C(CN-)>C(OH-)>C(H+);
故答案为:C(Na+)>C(CN-)>C(OH-)>C(H+
(2)(1)NH4Cl+NaOH═NH3.H2O+NaCl
? 反应前 0.01mol 0.002mol
? 反应 0.002mol 0.002mol? 0.002mol? 0.002mol
? 反应后0.008mol? ?0? 0.002mol? 0.002mol
所以溶液中的溶质是NH4Cl、NH3.H2O、NaCl;
①无论NH4+水解程度和 NH3.H2O的电离的程度如何,但遵守物料守恒,即NH4+和 NH3.H2O的物质的量之和为0.01mol,故答案为;0.02mol;
②溶液中阴阳离子所带电荷相同,溶液中存在的离子为Na+、Cl-、NH4+、OH-、H+,
即n(Na+)+n(NH4+)+n(H+)=n(Cl-)+n(OH-),
溶液中n(OH-)+n(Cl-)-n(NH+4)=n(Na+)+n(H+),
故答案为:n(Na+)+n(H+).
本题解析:
本题难度:一般
4、填空题 回答下列问题:
Ⅰ、有下列物质:①Fe ②CO2 ③Na2O ④Cu(OH)2 ⑤MgCl2 ⑥NH4Cl ⑦H2SO4
⑧C2H5OH(酒精)(用序号作答).
上述十种物质中,其中属于电解质的有______,属于非电解质的有______.
Ⅱ、今有K2SO4和Al2(SO4)3的混合溶液,已知其中K+浓度是0.2mol?L-1,SO42-的浓度是0.7mol?L-1.
(1)写出Al2(SO4)3电离的电离方程式:______.
(2)Al3+浓度应等于______mol/L
Ⅲ、根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题:
(1)该反应中氧化剂是______,被氧化的是______元素.
(2)该反应中参加氧化还原的氧化剂与还原剂的物质的量之比为______.
(3)用双线桥法标出电子转移的方向与数目______.
参考答案:I.①Fe是单质,既不是电解质也不是非电解质;②CO2 本身不能电离,属于非电解质;③Na2O是化合物且熔融状态下导电,属于电解质;④Cu(OH)2是化合物且熔融状态下导电,属于电解质;⑤MgCl2是化合物,在水溶液或者熔融状态都导电,属于电解质;⑥NH4Cl是化合物溶液中导电,属于电解质; ⑦H2SO4 是化合物溶液中导电,属于电解质;⑧C2H5OH(酒精)是化合物,在水溶液和融化状态下都不导电,是非电解质,故答案为:③④⑤⑥⑦;②⑧;
II.(1)硫酸铝是强电解质完全电离,电离方程式:Al2(SO4)3=2Al3++3SO42-;
故答案为:Al2(SO4)3=2Al3++3SO42-;
(2)溶液呈中性,根据电荷守恒列关系式:C(Al3+)×3+C(K+)=2×C(SO42-),将各种离子浓度带入得:C(Al3+)×3+0.2mol?L-1=2×0.7mol?L-1.
C(Al3+)=0.4mol/L;
故答案为:0.4mol/L;
III (1)该反应氨气中的氯气中的氯元素化合价降低,所以氯气是氧化剂;氮元素化合价升高,被氧化;
故答案为:Cl2或氯气;N或氮;
(2)在反应8NH3+3Cl2=6NH4Cl+N2,3mol氯气中的氯元素化合价都降低,所以3mol氯气都做氧化剂;8mol氨气中只有2mol氨气中的氮元素化合价升高,所以做还原剂的氨气只有2mol,所以氧化剂和还原剂物质的量之比是3:2;
故答案为:3:2;
(3)根据得失电子守恒的原理用双线桥法标出电子转移的方向与数目.
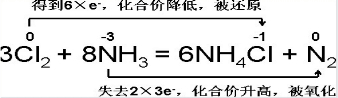 ;
;
故答案为: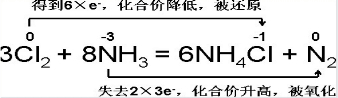 .
.
本题解析:
本题难度:一般
5、选择题 下列操作不能达到预期目的是( )
A.

检查装置气密性
B.
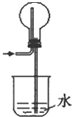
HCl的吸收
C.
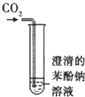
碳酸、苯酚酸性强弱比较
D.
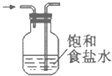
除去氯气中的氯化氢
参考答案:A.用弹簧夹夹住右边导管,向长颈漏斗中倒水,装置内外的压强不相等,液面高度不变,说明装置气密性良好,反之漏气,所以该装置能达到预期目的,故A正确;
B.该装置中,因左导管伸入烧瓶中较长,烧杯中的水进入烧瓶后不易发生倒吸,该装置既能够吸收易溶性气体,又能够防止倒吸,能吸收氯化氢,所以该装置能达到预期目的,故B正确;
C.二氧化碳通入到澄清的苯酚钠溶液中,二氧化碳和水和苯酚钠反应CO32-+2CH3COOH→2CH3COO-+H2O+CO2↑,试管中出现澄清的苯酚钠溶液变浑浊,原因是碳酸的酸性强于苯酚,水和二氧化碳反应生成碳酸,碳酸和苯酚钠反应生成苯酚和碳酸氢钠,可判断碳酸、苯酚酸性的强弱,所以该装置能达到预期目的,故C正确;
D.因氯气与水发生:Cl2+H2O?H++Cl-+HClO,则氯气难溶于饱和食盐水,但HCl极易溶于水,可用饱和食盐水除去氯气中少量的氯化氢气体,但气体进入洗气瓶时应该是长管进短管出,所以图中装置不能达到预期目的,故D错误;
故选D.
本题解析:
本题难度:简单