微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 叠氮酸钠(NaN3)是无色离子晶体,遇高温或剧烈震动能发生强烈爆炸,快速分解成钠单质和氮气,是汽车安全气囊中的成分之一。下列有关说法正确的是
A.NaN3中只含有离子键
B.1molNaN3完全分解最多可以产生33.6LN2
C.NaN3快速分解时,NaN3既是氧化剂,又是还原剂
D.常温下,NaN3化学性质稳定,包装盒上无需特别说明注意事项
参考答案:C
本题解析:NaN3是Na+和N3—构成的离子化合物,N3—中氮元素与氮元素之间还存在共价键,故A选项错误;依题意可得:2NaN3 2Na+3N2↑,由于其中N2与NaN3的系数之比等于物质的量之比,则1mol NaN3完全分解最多可以产生1.5molN2,由于缺少温度和压强,气体摩尔体积不一定是22.4L/mol,则氮气的体积不一定是33.6L,故B选项错误;由于2NaN3
2Na+3N2↑,由于其中N2与NaN3的系数之比等于物质的量之比,则1mol NaN3完全分解最多可以产生1.5molN2,由于缺少温度和压强,气体摩尔体积不一定是22.4L/mol,则氮气的体积不一定是33.6L,故B选项错误;由于2NaN3 2Na+3N2↑中钠元素化合价降低,氮元素化合价升高,则NaN3既是氧化剂又是还原剂,故C选项正确;由于NaN3在高温或剧烈震动能够发生强烈爆炸,因此需要说明安全警示标志,故D选项错误。
2Na+3N2↑中钠元素化合价降低,氮元素化合价升高,则NaN3既是氧化剂又是还原剂,故C选项正确;由于NaN3在高温或剧烈震动能够发生强烈爆炸,因此需要说明安全警示标志,故D选项错误。
本题难度:一般
2、填空题 (12分)X、Y、Z、W为常见含有相同电子数的离子或分子,其中X有5个原子核,这些微粒与一氧化氮间有如下转化关系(图中部分反应物、产物及反应条件已略去)。
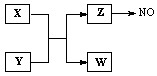
(1)Z →NO反应的化学方程式是:?
液态 Z与水的电离相似,其中存在的电子数相同的两种微粒是?。
(2)实验室中检验Z的化学试剂及现象是:
(3)由构成X、Y的三种元素所组成的一种离子化合物,且三种元素原子数之比为2:4:3,该离子化合物是?(填写化学式)。
(4)一定条件下,Z与一氧化氮或二氧化氮反应均可生成两种很稳定的产物。若有二氧化氮与Z的混合气体20 mL在该条件下反应,实际参加反应的二氧化氮比Z少2 mL,则原混合气体中Z与二氧化氮的体积比是?。
参考答案:(12分)
(1) ? NH2—、NH4+
? NH2—、NH4+
(2)
?
?化学试剂
?现象
方法一
用湿润的红色石蕊试纸检验(1分)
试纸变为蓝色(1分)
方法二
蘸有浓盐酸的玻璃棒检验(1分)
有白烟生成(1分)
(3)NH4NO3;
(4)2﹕3或7:3
本题解析:本题主要考查了微粒结构、氨气的性质及检验;氧化还原反应的相关知识;
(1)联想常见的10电子微粒,再依题意很容易知道:X为NH4+、Y为OH—、Z为NH3、W为H2O;
(4)4NH3 + 3NO2 =2N2 + 6H2O
设参加反应的NH3为a ml,则参加反应的NO2为3a/4,即a-3a/4=2,a=8。
所以参加反应的NH3为8 ml,NO2为6ml;由于二者共20 ml,很容易算出
NH3过量:NH3为14 ml,NO2为6 ml,二者体积比为7:3
NO2过量:NH3为8 ml,NO2为12 ml,二者体积比为2:3
本题难度:一般
3、选择题 用26.4 g(NH4)2SO4跟过量的Ca(OH)2混合加热,放出的气体全部被含有39.2 g的H3PO4溶液吸收,生成的盐是(?)
A.(NH4)3PO4
B.NH4H2PO4
C.(NH4)2HPO4
D.(NH4)3PO4和NH4H2PO4
参考答案:B
本题解析:产生NH3为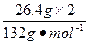 ="0.4" mol,H3PO4为
="0.4" mol,H3PO4为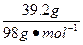 ="0.4" mol,所以NH3与H3PO4的物质的量之比为1∶1,故生成NH4H2PO4。
="0.4" mol,所以NH3与H3PO4的物质的量之比为1∶1,故生成NH4H2PO4。
本题难度:简单
4、填空题 (10分)发射航天火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题:
(1)N2H4燃烧时用NO2作氧化剂,它们相互反应生成氮气和水蒸气。
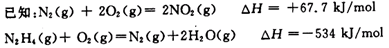
则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为?。
(2)利用肼、氧气与KOH溶液组成碱性燃料电池,氮元素被氧化后只生成氮气,请写出该电池工作时负极的电极反应?;电池工作时,?极pH升高。
(3)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的化学方程式?。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式?。
参考答案:
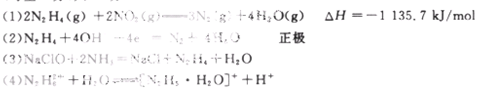
本题解析:(1)将两个方程式叠加得:N2H4和NO2反应生成氮气和水蒸气的热化学方程式为
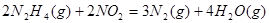 △
△ ;
;
(2)电池工作时负极的电极反应为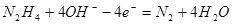 ;电池工作时,正极PH升高;
;电池工作时,正极PH升高;
(3)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的化学方程式为:

(4) ?
?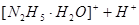
本题难度:简单
5、选择题 新华网酒泉9月20日电:由我国独立研制的“长征”系列运载火箭是中国航天的主力运载工具,自1996年10月以来,已连续进行366次成功发射。若某火箭推进器中的燃料是液态偏二甲基肼[(CH3)2N—NH2],氧化剂是N2O4,发生的反应可写为:(CH3)2N—NH2+2N2O4===3N2↑+2CO2↑+4H2O↑。下列有关说法不正确的是( )
A.火箭点火后瞬间,逸出红棕色气体是NO2
B.偏二甲基肼[(CH3)2—N—NH2]与均二甲基肼[CH3NH—NH—CH3]沸点不相同
C.每生成3 mol氮气,转移电子的物质的量为16 mol
D.在宇宙飞船船舱中比在地球上更容易做过滤实验
参考答案:D
本题解析:因N2O4?2NO2,故逸出的红棕色气体是NO2,A项正确;偏二甲基肼与均二甲基肼,互为同分异构体,因熔沸点不相同,B项正确;反应过程中每生成3 mol氮气、转移16 mol电子,C项正确;因在宇宙飞船船舱中处于失重状态,过滤实验操作难以进行,D项错误。
本题难度:一般