微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 为证明稀硝酸与铜反应产物中气体为NO,设计如图实验(实验过程中活塞2为打开状态),下列说法中不正确的是
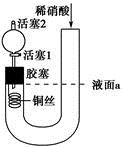
A.关闭活塞1,加入稀硝酸至液面a处
B.在装置左侧稍加热可以加快稀硝酸与铜的反应速率
C.通过关闭或开启活塞1可以控制反应的进行
D.反应开始后,胶塞下方有无色气体生成,还不能证明该气体为NO
参考答案:A
本题解析:如果关闭活塞1,稀硝酸加到一定程度后,左侧液面将不再升高,即不可能加到液面a处,A错误。B正确。关闭活塞1时,产生的气体聚集在铜丝附近使得U形管液面左低右高,当左面铜丝接触不到硝酸后,反应停止;由于活塞2是打开的,打开活塞l后,两边液面恢复水平位置,继续反应,所以活塞l可以控制反应的进行,C项正确。胶塞下方有无色气体生成,此时还要打开活塞1使得该气体进入上面的球体里,看到有红棕色现象(生成NO2)才能证明生成的是NO气体,D正确。
本题难度:简单
2、实验题 氨气在工农业生产中有重要的用途。某校甲、乙两个化学小组分别对氨的相关实验进行了研究。

(1)甲、乙两小组选择了不同方法制取氨气,
请将实验装置的字母编号和制备原理填写在下表空格中。
?
| 实验装置
| 实验药品
| 制备原理
|
甲小组
| A
| 氢氧化钙、氯化铵
| 反应的化学方程式为
①?
|
乙小组
| ②
| 浓氨水、氢氧化钠
| 用化学平衡原理分析氢氧化钠的作用:
③?
|
?
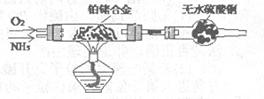
(2)甲组通过右图装置(尾气处理装置已略去)验证了氨有还原性,装置中的实验现象是____?,硬质玻璃管中氨发生催化氧化反应的化学方程式为?。
(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,现象为?,
反应结束所得溶液中除了H+、OH-、NH4+外还主要含有的离子有?。
(4)乙组欲制备氮化镁,查阅资料发现氨跟氧化铜反应可以制备氮气(2NH3+3CuO 3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由?。
3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由?。
参考答案:(1)① 2NH4Cl+Ca(OH)2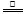 CaCl2+2H2O+2NH3↑。(2分)②B?(1分)
CaCl2+2H2O+2NH3↑。(2分)②B?(1分)
③固体NaOH溶于浓氨水后,放出大量的热,促使NH3的挥发;溶液中OH-浓度的增加,使NH3+H2O NH3·H2O
NH3·H2O NH4+?+OH-向生成NH3的方向移动。(2分)
NH4+?+OH-向生成NH3的方向移动。(2分)
(2)玻璃管中出现红棕色,干燥管中固体变蓝(2分)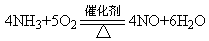 ?(2分)
?(2分)
(3)先产生白色沉淀,后消失;溶液最后变成红色(2分)Ag(NH3)2+、NO3-?(2分)
(4)方案错误;反应产生的NH3全部被H2SO4吸收,不能进行后续反应。(2分)
本题解析:(1)①氢氧化钙、氯化铵制取氨气的化学方程式为2NH4Cl+Ca(OH)2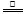 CaCl2+2H2O+2NH3↑
CaCl2+2H2O+2NH3↑
②浓氨水、氢氧化钠制取氨气应选择B装置,
③氨水中存在NH3+H2O NH3·H2O
NH3·H2O NH4+?+OH-的平衡,加入NaOH固体,一是OH-浓度增大,平衡逆向移动;二是NaOH固体溶于水后放出大量的热,促使NH3的挥发;
NH4+?+OH-的平衡,加入NaOH固体,一是OH-浓度增大,平衡逆向移动;二是NaOH固体溶于水后放出大量的热,促使NH3的挥发;
(2)氨气与氧气在催化剂作用下生成一氧化氮气体,该气体遇空气变为红棕色二氧化氮;同时还有水生成,所以无水硫酸铜变蓝色;
(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,氨气溶于水后,溶液显碱性,与Ag+反应生成氢氧化银沉淀,继续通氨气产生氢氧化二氨合银,沉淀溶解,最终溶液变红色;反应结束所得溶液中除了H+、OH-、NH4+外还主要含有的离子Ag(NH3)2+、NO3-?
(4)不正确,反应产生的氨气全部被浓硫酸吸收,无法进行后面的反应
本题难度:困难
3、选择题 下列结论正确的是(?)
①粒子半径:S2->Cl>S>F?②氢化物的稳定性:HF>HCl>H2S>H2Te?③离子的还原性:S2->Cl->Br->I-?④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4?⑥非金属性:F>Cl>S>Se
A.②④⑥
B.①③④
C.只有①
D.⑥
参考答案:A
本题解析:因为同周期元素原子半径从左到右递减,即r(Cl)<r(S),①错;非金属性:F>Cl>S>Te,所以氢化物稳定性HF>HCl>H2S>H2Te,②正确;单质氧化性:Cl2>Br2>I2>S,则阴离子还原性:S2->I->Br->Cl-,③错误;已知氧化性:Cl2>S,而S>Se>Te,④正?确;HClO4为最强的无机酸,⑤错误;非金属性:F>Cl,S>Se,又知Cl>S,所以⑥正确。
本题难度:简单
4、选择题 下列各组化合物中的氮元素,具有相同化合价的是?(?)
A.NO和NO2
B.NO2和N2O4
C.NH3和NH4Cl
D.N2O和HNO2
参考答案:BC
本题解析:略
本题难度:简单
5、填空题 (16分)有分别含有A、B、C、D、E、F的六瓶无色溶液,这六种溶质均是中学化学中常用的无机试剂。已知纯E为无色油状液体,溶于水时会放出大量热;B、C、D和F是常见金属的盐,且它们的阴离子均不同。现进行如下实验:
①A的溶液有刺激 性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A的溶液分别加入其它五种物质的溶液中,只有溶有D、F的溶液中有白色沉淀产生;继续加入过量A溶液时,D中沉淀无变化,F中沉淀完全溶解;
③将B的溶液分别加入C、D、E、F的溶液中,含C、D、F的三种溶液中均产生沉淀,E溶液中有无色、无味气体逸出;
④将C的溶液分别加入D、E、F中,均有白色沉淀生成,再加入稀HNO3,沉淀均不溶。根据上述实验信息,请回答下列问题:
(1)确定化学式A??C?.? E?
(2)写出F中沉淀完全溶解的化学方程式?。
(3)B在溶液中电离出的阴离子为?(填化学式),能否确定B在溶液中电离生产的阳离子?若能,写出离子符号,若不能说明进一步鉴定的方法。?。
(4)D在溶液中电离出的阴离子为?(填化学式),能否确定D在溶液中电离生产的阳离子?若能,写出离子符号,若不能说明进一步鉴定的方法。?。
参考答案:(1)? NH3? BaCl2? H2SO4
(2)AgOH+2NH3·H2O=" Ag" (NH3)2OH+2H2O
(3)CO32--?用洁净的铂丝蘸取少量B的溶液,在酒精灯火焰中灼烧,若焰色呈黄色则B为Na2CO3溶液;若透过蓝色钴玻璃观察焰色呈紫色,则B为K2CO3溶液
(4)SO42?-取少量D的溶液,向其中滴加NaOH溶液有沉淀 生成,继续滴加过量的NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶解,则D为MgSO4溶液
生成,继续滴加过量的NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶解,则D为MgSO4溶液
本题解析:略
本题难度:困难