微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 常温常压下,O3为淡蓝色有特殊臭味的气体,工业上常用O3作为造纸、纺织等行业的漂白和脱色剂,也可用作饮用水的消毒和杀菌剂,但O3浓度超标时会因其强氧化性而对人体产生毒副作用。自然条件下打雷时空气中会有部分O2转化为O3。
实验室现提供以下装置和药品,请你完成O3的制备及性质验证实验。
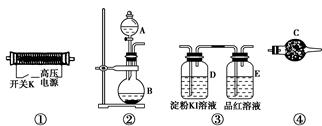
请回答以下问题:
(1)以上装置的连接顺序为______接______接________接________。
(2)A中应装入的试剂为________(写化学式);B中发生反应的化学方程式为____________________________________________________。
(3)检验整个装置的气密性的具体操作是__________________________。
(4)实验开始时,取下分液漏斗的塞子,断开电源开关K,再旋开分液漏斗的活塞,持续通入气体一段时间,其目的是________、________。然后合上电源开关K,试预测下列装置中可能观察到的现象及对应的结论。
D装置中:___________________________________________________;
E装置中:____________________________________________________。
(5)请指出该实验装置中的不妥之处并改进:_________________________。
参考答案:(1)② ④ ① ③
(2)H2O2 2H2O2催化剂,2H2O+O2↑(或H2O 2Na2O2+2H2O=4NaOH+O2↑,注意对应)
(3)关闭分液漏斗的活塞,用热毛巾捂住烧瓶B,观察D、E的导管口是否有气泡冒出,松手片刻后观察导管内液面是否升高
(4)排出装置中的N2,防止生成氮氧化物干扰实验结果
导入O2进行对比实验,保证结果的准确性 无色溶液变蓝色,导管口产生气泡,试剂瓶上部有淡蓝色气体,证明O3有强氧化性 品红溶液褪色,导管口产生气泡,试剂瓶上部有淡蓝色气体,证明O3有漂白性
(5)没有尾气处理装置,应在E的导管口连接尾气处理装置
本题解析:(1)①装置的作用是利用氧气产生臭氧,②装置的作用是制备氧气,③装置的作用是检验臭氧的强氧化性和漂白性,④装置的作用是除去氧气中混有的水蒸气,故装置的连接顺序为②④①③。(2)②装置的作用是制备氧气,可以利用反应2H2O2催化剂,2H2O+O2↑或2Na2O2+2H2O=4NaOH+O2↑来制备。(4)“持续通入气体一段时间”,通入的是氧气,可以排出装置中的N2,防止生成氮氧化物干扰实验结果。KI具有还原性,若无色溶液变蓝色,则证明O3有强氧化性;若品红溶液褪色,则证明O3有漂白性。(5)臭氧“也可用作饮用水的消毒和杀菌剂,但浓度超标时会因其强氧化性而对人体产生毒副作用”,故没有反应完的臭氧应进行处理,在E的导管口连接尾气处理装置。
本题难度:一般
2、实验题 工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
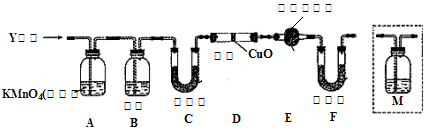
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是?
另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
(2)甲同学认为X中除Fe3+外还可能含有Fe2+,若要确认其中的Fe2+,可选用?(选填序号)。
a.KSCN溶液和氯水?b.K3Fe(CN)6溶液?c.浓氨水?d.酸性KMnO4溶液
参考答案:(10分)
(1)铁钉表面形成致密的氧化物薄膜,阻止铁和硫酸铜反应(或其他合理答案)(2分)
(2)bd(2分)?
(3)检验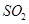 是否除尽(1分)
是否除尽(1分)
(4)C+2H2SO4(浓) CO2+2SO2+2H2O(2分)
CO2+2SO2+2H2O(2分)
(5)c(1分)
(6)D中固体由黑变红和E中固体由白变蓝(2分)
本题解析:(1)该操作使铁钉表面形成致密的氧化物薄膜,阻止铁和硫酸铜反应
(2)X中含有Fe3+,不能用a.KSCN溶液和氯水或c.浓氨水检验,而b.K3Fe(CN)6溶液和d.酸性KMnO4溶液能与Fe2+反应使溶液颜色发生变化,故本题选bd;
点评:对化学实验的考查是历年高考的重点,也是一个难点。解题的关键在于对实验基础知识的掌握,以及对基本实验流程的了解。实验的流程一般遵循“制备装置-除杂装置-性质检验装置-收集装置-尾气处理装置”。
本题难度:一般
3、判断题 按下面配方浸液配方可制无泥皮蛋:NaOH 6g、NaCl 10g、Ca(OH)2 69g、茶叶 5g、水210mL(可浸泡4只鸡蛋)。配制浸液时,可以用生石灰和纯碱代替氢氧化钙和氢氧化钠。请用化学方程式说明理由。
参考答案:CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
生石灰与纯碱在水溶液中混合后会发生反应,生成氢氧化钙和氢氧化钠
本题解析:生石灰与纯碱在水溶液中混合后会发生反应,生成氢氧化钙和氢氧化钠,具体反应的化学方程式为: CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
本题难度:简单
4、实验题 某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
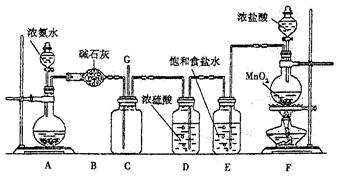
请回答下列问题:
(1)装置A中的烧瓶内固体不可以选用??(选填序号)。
A.生石灰? B.碱石灰? C.五氧化二磷? D.烧碱
(2)B装置的作用????;E装置的作用??????。
(3)通入C装置的两根导管左边较长、右边较短,目的是??。
(4)装置F中发生反应的化学方程式是??。
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:????。
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?
??。
参考答案:(1)C;(2)干燥氨气;除去氯气中的氯化氢;(3)使密度较大的Cl2和密度较小的NH3较快地混合均匀;(4)MnO2 + 4HCl(浓)△MnCl2 + Cl2↑+2H2O;(5)3Cl2 + 8NH3=N2 + 6NH4Cl;(6)在G连接导管,直接把尾气通入盛有烧碱溶液的烧杯中。
本题解析:(1)装置A制取氨气,可用浓氨水与碱石灰(或烧碱或生石灰等),但部能用五氧化二磷,因其与水反应后生成磷酸,能与氨水反应;(2)B装置中盛放的碱石灰,用来干燥氨气;E装置中盛放的饱和食盐水,用来除去氯气中混有的氯化氢气体;(3)由于氨气的密度小,氯气的密度大,密度小氨气的从长管进入向上扩散,密度大的氯气从短管进入向下扩散,这样能较快的充分的混合;(6)黄绿色的气体是氯气,依据氯气的性质,可用烧碱溶液吸收。
本题难度:简单
5、实验题 下图是一个实验室制取氯气并以氯气为原料进行特定反应的装置图。
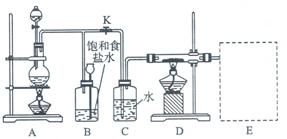
(1)A是氯气发生装置,其中发生反应的离子方程式为 ?。
(2)实验开始时,先点燃A处酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。则该反应的化学方程式为??,装置C的作用是?
(3) 该装置图尚未画完,请在E处补充完整,并注明试剂名称。
(4)D处反应完结后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,则B的作用是?。
参考答案:(1) MnO2+4H++2Cl- Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑
(2)? C+2Cl2+2H2O CO2+4HCl?,?提供水蒸汽?
CO2+4HCl?,?提供水蒸汽?
(4) 储存氯气
本题解析:(1) MnO2+4H++2Cl- ?Mn2++2H2O+Cl2↑ 注意MnO2写化学式,浓盐酸拆成离子形式,注意配平。(2)C+2Cl2+2H2O
?Mn2++2H2O+Cl2↑ 注意MnO2写化学式,浓盐酸拆成离子形式,注意配平。(2)C+2Cl2+2H2O  ?CO2+4HCl,C提供水蒸汽(3)注意收集气体装置。
?CO2+4HCl,C提供水蒸汽(3)注意收集气体装置。
(4)B的作用是储存氯气
点评:氯气的制取实验是历年高考的重点和难点,本题在旧的知识上有新的拓展,注意氯气的制备装置,即可找到突破口。
本题难度:一般