向混合液中加入浓溴水,充分反应后,过滤
参考答案:A
本题解析:A、水中羟基的氢原子活泼性强于乙醇分子中羟基氢原子的活泼性,乙醇比较水和乙醇中羟基氢的活泼性强弱可以用金属钠分别与水和乙醇反应,A正确;B、丙烯醛分子中的碳碳双键和醛基均被酸性高锰酸钾溶液氧化,所以不能用滴入酸性KMnO4溶液,看紫红色是否褪去来证明CH2=CHCHO中含有碳碳双键,B不正确;C、确定碳、氯两元素非金属性的强弱,应该测定同温同浓度的Na2CO3和NaClO4水溶液的pH,C不正确;D、苯酚能与浓溴水反应,但生成的三溴苯酚又溶解在苯中,因此欲除去苯中混有的苯酚应该用氢氧化钠溶液,D不正确,答案选A。
本题难度:一般
2、实验题 (13分)硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.[制备产品]
实验装置如图所示(省略夹持装置)
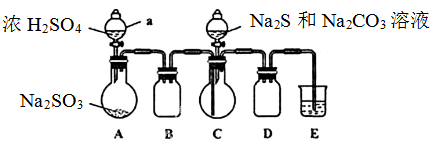
实验步骤:
(1)检查装置气密性,按图示加入试剂。仪器a的名称是____;E中的试剂是___(选填下列字母编号)。
A.稀H2SO4? B.NaOH溶液? C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经____(填写操作名称)、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_____,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原有实验步骤(2)进行了改进,改进后的操作是_______。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过_____方法提纯。
参考答案:Ⅱ.(1)分液漏斗;B?(3)蒸发
Ⅲ. (1)过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀HCl。
(2)先向A中烧瓶滴加浓硫酸,产生的气体将装置中空气排尽后,再向C中烧瓶 加入Na2S和Na2CO3混合溶液。(3)重结晶
本题解析:Ⅱ.[制备产品]
(1)根据仪器的构造特点可知,仪器a的名称是分液漏斗。根据装置可知,A装置是制备SO2的,C装置是制备得Na2S2O3,BD装置是防倒吸的,由于SO2有毒,需要尾气处理,因此E装置是吸收SO2的。由于SO2是酸性氧化物,可以用氢氧化钠溶液吸收,即E中的试剂是氢氧化钠溶液,答案选B。
(3)由于Na2S2O3·5H2O是无色透明晶体,易溶于水,因此要从溶液中得到硫代硫酸钠晶体,责问需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(1)Na2S2O3·5H2O的稀溶液与BaCl2溶液混合无沉淀生成,而实验过程中有白色沉淀生成,因此要进一步验证,则可以向白色沉淀中滴加稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)由于亚硫酸盐易被氧化生成硫酸盐,而装置中含有空气,空气能氧化亚硫酸盐,所以为减少装置C中生成的Na2SO4的量,改进后的措施是先向A中烧瓶滴加浓硫酸,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液。
(3)由于Na2S2O3·5H2O的溶解度随温度升高显著增大,因此所得产品通过重结晶方法提纯。
本题难度:一般
3、实验题 (10分)某化学学习小组在实验室里利用下图装置测定中和反应中的热效应。实验时将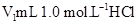 溶液和 溶液和 未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,所得实验结果如右下图所示(实验中始终保持 未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,所得实验结果如右下图所示(实验中始终保持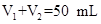 )。 )。
据此请回答下列问题:
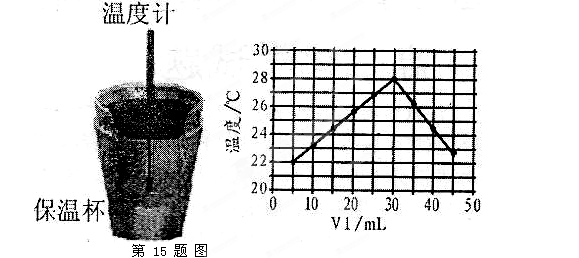 (1)从实验装置上看,左图中尚缺少的一种玻璃用品是________________________。 (1)从实验装置上看,左图中尚缺少的一种玻璃用品是________________________。
(2)保温杯的作用是_______________________________________________________。
(3)某同学根据所得数据,提出了以下观点,其中正确的是______________________。
A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.该实验表明有水生成的反应都是放热反应
(4)利用图中所给数据,可测得NaOH溶液的浓度约为______________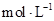
(5)除了使用保温杯外,为了保证实验成功,还要注意哪些问题(说出1点即
可) ____________________________
参考答案:(1)环形玻璃搅拌器(2)防止热量散失(3)B (4)1.5 (5)使用的盐酸和氢氧化钠溶液的浓度要小不要大;温度计的水银球部分要完全浸在溶液中(合理给分)。
本题解析:(1)反应时需要搅拌,所以还缺少环形环形搅拌棒。
(2)在实验中,应该尽可能减少热量的损失,所以保温杯的作用是减少热量的损失。
(3)根据图像可知,当V1=0时,溶液的温度不是22℃,A不正确。随着反应的进行,溶液的温度升高,所以反应放热,B正确。选项C和实验无关系,不正确,答案选B。
(4)当酸碱恰好反应时,放出的热量最多,所以根据图像可判断,氢氧化钠的浓度是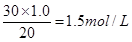 。 。
(5)在实验中,应该尽可能减少热量的损失,所以使用的盐酸和氢氧化钠溶液的浓度要小不要大;温度计的水银球部分要完全浸在溶液中
本题难度:一般
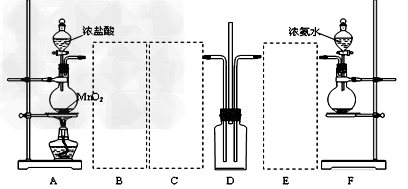
4、实验题 某学习小组利用下列装置探究氯气氨气之间的反应,其中A、F分别为氯气和氨气的发生装置,D为纯净的氯气和氨气的反应装置。?
请回答下列问题:
(1)?装置F中烧瓶内的固体可选用_____________。
A、氯化铝?B、生石灰?C、五氧化二磷?D、烧碱
(2)实验中所用的浓盐酸的质量分数为36.5%,其密度为1.19?g/cm3,则其物质的量浓度为__________(保留一位小数),在标况下需____________L(保留一位小数)氯化氢溶于1L水中才可得此浓度的盐酸。
(3)虚线框内应添加必要的除杂装置,请将除杂装置中相应的试剂名称填入下列空格中:B__________;C_____________;E_____________。
(4)装置D内出现白烟并在容器内壁凝结,鉴定该固体中的阳离子所需要的试剂有:?__________。写出装置D中反应的化学方程式___________。该反应中氧化剂与还原剂物质的量之比为____________。
参考答案:(1)BD?
(2)11.9mol/L;352.7?
(3)饱和食盐水;浓硫酸;碱石灰
(4)NaOH溶液和湿润的红色石蕊试纸?;8NH3+3Cl2?=?N2+6NH4Cl?;3:2
本题解析:
本题难度:一般
5、选择题 下列有关实验操作的说法正确的是
A.加入盐酸以除去硫酸钠中的少许碳酸钠杂质
B.用洁净的玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH
C.向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1 AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大
D.可用25.00ml碱式滴定管量取20.00ml 溴水
参考答案:
C
本题解析:略
本题难度:简单
|