微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 应用元素周期律的有关知识,可以预测我们不知道的一些元素及其化合物的性质。下列预测中不正确的是
①Be的氧化物的水化物可能具有两性
②Tl能与盐酸和NaOH溶液作用,均产生氢气
③At单质为有色固体,At难溶于水易溶于四氯化碳
④Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
⑤SrSO4是难溶于水的白色固体
⑥H2Se是无色、有毒,比H2S稳定的气体
A.①②③④
B.②④⑥
C.①③⑤
D.②④⑤
参考答案:B
本题解析:在周期表中Be和Al处于对角线关系,氧化铝是两性氧化物,则Be的氧化物的水化物可能具有两性,①正确;Tl和Al处于同一主族,同主族自上而下金属性逐渐增强,因此Tl能与盐酸反应产生氢气,但不能和NaOH溶液作用产生氢气,②不正确;卤素单质均是有色物质,难溶于水易溶于有机溶剂中。At也是卤素,因此At单质为有色固体,At难溶于水易溶于四氯化碳,③正确;Li在氧气中剧烈燃烧,产物是LiO2,Li没有过氧化物,④不正确;第ⅡA族元素的硫酸盐均是难溶性物质,Sr是第ⅡA族元素,所以SrSO4是难溶于水的白色固体,⑤正确;同主族阻塞性非金属性逐渐减弱,氢化物的无锡逐渐减弱,所以H2S比H2Se稳定,⑥不正确,答案选B。
本题难度:一般
2、选择题 下列说法正确的是
A.原子最外层电子数为2的元素一定处于周期表IIA族
B.主族元素X、Y能形成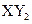 型化合物,则X与Y 的原子序数之差可能为2或5
型化合物,则X与Y 的原子序数之差可能为2或5

C.氯化氢的沸点比氟化氢的沸点高
D.同主族元素形成的氧化物的晶体类型均相同
参考答案:B
本题解析:略
本题难度:简单
3、填空题 (7分)填空回答:
(1)氮化硅是一种高温陶瓷材料。根据元素周期律知识,写出氮化硅的化学式:??。
(2)有A、B、C、D、E、F六种元素,它们均属短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
形成的化合物
| 甲
| 乙
| 丙
| 丁
| 戊
|
化合物中各元素的原子个数比
| A:C=2:1
| B:A=1:3
| D:C=1:1
| E:F=1:3
| A:F=1:1
|
已知A、B两元素的核电荷数之差等于其原子最外层电子数之和;B原子最外层电子数比次外层电子数多3个;C原子的最外层电子数是次外层电子数的3倍;D、E、F同周期,D、A同主族;E与F的原子序数之和为30,丙是离子化合物。回答:
① F元素位于周期表中的位置??。
② E元素的原子结构示意图为?,B的最高价氧化物的水化物的化学式为?。
③向丙物质中滴加甲的化学反应方程式为?。
参考答案:(1)Si3N4(2分) (2) ①第三周期第VII族(1分)②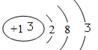 (1分) HNO3(1分)
(1分) HNO3(1分)
③2Na2O2+2H2O=4NaOH+O2↑(2分)
本题解析:(1)氮元素的的非金属性强于Si元素,其中氮元素的最低价是-3价,Si的最高价是+4价,所以氮化硅的化学式为Si3N4。
(2)B原子最外层电子数比次外层电子数多3个,则B是氮元素。C原子的最外层电子数是次外层电子数的3倍,所以C是氧元素。根据甲中原子个数之比可知,A是氢元素,甲是水,乙是氨气。D、A同主族,所以根据原子序数大小顺序可知,D是Na元素,则丙是过氧化钠。D、E、F同周期,且E与F的原子序数之和为30,所以E是Al,F是Cl,丁是AlCl3,戊是HCl。
点评:该题是高考中的常见题型,属于中等难度的试题,试题基础性强,侧重考查学生的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
4、填空题 (12分)A、B、C、D、E、F均为元素周期表前20号主族元素,其核电荷数依次增大。其中A、B同周期,B、D同主族且相邻,A、B、D三种元素的核电荷数之和为30。C、E同周期,可形成1:1型的离子化合物。F的最外层电子数大于1。请回答:
(1)A、B、C、D、E、F六种元素的元素符号分别为_______________________?__;
(2)用化学式表示A、D、E最高价氧化物的水化物酸性由强到弱的顺序:_______;
(3)用化学式表示D、E氢化物的还原性由强到弱的顺序:_______;
(4)请写出C、E最高价氧化物对应水化物之间反应的化学方程式:________________。
参考答案:(共12分)(1)C、O、Na、S、Cl、Ca (各1分)(2)HClO4>H2SO4>H2CO3 ?(2分)(3)H2S> HCl(2分)?(4)HClO4 + NaOH ==NaClO4 + H2O(2分)
本题解析:B、D同主族且相邻,则B是第二周期,D是第三周期。C、E同周期,可形成1:1型的离子化合物,则该化合物应该是氯化钠或硫化镁。如果是硫化镁,则BD的原子序数之和就≤22,则A的原子序数最小是8,这和A的原子序数小于B的矛盾,所以C是钠,E是氯,则A是碳,B是氧元素,D是硫元素,F是钙。
(1)分别是C、O、Na、S、Cl、Ca。
(2)非金属性越强,最高价氧化物的水化物的酸性越强,非金属性是Cl>S>C,则酸性强弱顺序是HClO4>H2SO4>H2CO3。
(3)非金属性越强,相应氢化物的还原性越弱,所以还原性强弱顺序是H2S> HCl。
(4)C、E最高价氧化物对应水化物分别是强酸和强碱,方程式为HClO4 + NaOH ==NaClO4 + H2O。
本题难度:简单
5、选择题 YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于8939Y的说法不正确的是(?)
A.属于金属元素
B.质子数与中子数之差为50
C.原子的核外电子数是39
D.8939Y和9039Y是两种不同的核素
参考答案:B
本题解析:依据题干信息可知,Y元素为39号元素,汉字为金字旁元素为金属元素,根据构造原理,核外电子排布式1S22S22P63S23P63d104S24P6?4d15S?2,字母前的数字表示电子层数,价电子是4d15S?2,价电子数之和=族序数,所以Y属第五周期第ⅢB族;A、该元素是副族元素,所以是金属元素,故A正确;B、质子数+中子数=质量数,质子数-中子数=质子数-(质量数-质子数)=39-(89-39)=-11.故B错误.C、原子的核外电子数等于核内质子数,所以核外有39个电子,故C正确;D、8939Y和9039Y是质子数相同中子数不同的同一元素,所以是不同的两种核素,互为同位素,故D正确;
故选B.
本题难度:一般