|
高中化学知识点大全《弱电解质电离平衡》高频考点特训(2017年练习版)(二)
2017-03-02 23:14:41
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,有关醋酸溶液的叙述中正确的是
A.用pH 计测得0.1 mol·L-1的CH3COOH溶液的 pH约2.9,说明CH3COOH是弱酸
B.将pH=3的醋酸稀释为pH=4的过程中, 比值不变 比值不变
C.向0.1 mol·L-1的CH3COOH溶液中加入少量CH3COONa固体,CH3COOH和H2O的电离程度都减小
D.pH=3的醋酸和盐酸分别与pH=11的NaOH溶液完全中和,两者消耗NaOH溶液的体积相同
|
参考答案:A
本题解析:A.用pH 计测得0.1 mol·L-1的CH3COOH溶液的 pH约2.9,这说明溶液中氢离子浓度小于0.1mol/L,因此溶液中醋酸存在电离平衡,所以CH3COOH是弱酸,A正确;B.将pH=3的醋酸稀释为pH=4的过程中醋酸分子的物质的量减小,氢离子的物质的量增加,所以 比值减小,B错误;C.向0.1 mol·L-1的CH3COOH溶液中加入少量CH3COONa固体,抑制醋酸电离,对水的电离抑制程度减弱,C错误;D.醋酸是弱酸,pH=3的醋酸和盐酸分别与pH=11的NaOH溶液完全中和,醋酸的浓度大于盐酸,因此两者消耗NaOH溶液的体积前者大于后者,D错误,答案选A。 比值减小,B错误;C.向0.1 mol·L-1的CH3COOH溶液中加入少量CH3COONa固体,抑制醋酸电离,对水的电离抑制程度减弱,C错误;D.醋酸是弱酸,pH=3的醋酸和盐酸分别与pH=11的NaOH溶液完全中和,醋酸的浓度大于盐酸,因此两者消耗NaOH溶液的体积前者大于后者,D错误,答案选A。
考点:考查醋酸溶液的有关判断
本题难度:一般
2、选择题 下列实验方案不能成功的是(?)
A.通过测浓度均为0.01 mol/L的溶液的pH大小来鉴别盐酸和乙酸?
B.向均含石蕊的盐酸和乙酸溶液中分别加入NaCl、CH3COONa来鉴别盐酸和乙酸是否为弱电解质?
C.加热蒸发FeCl3溶液制备FeCl3晶体?
D.测均为0.1 mol/L的NaCl、CH3COONa溶液的pH来鉴别盐酸和乙酸是否为弱电解质
参考答案:C
本题解析:略
本题难度:一般
3、填空题 回答下列问题。
(1)常温时,FeCl3溶液的pH?7(填“>”、“<”或“=”),实验室配制FeCl3溶液时常将FeCl3固体先溶于较浓的盐酸溶液中,然后再用蒸馏水稀释到所需的浓度,原因是?;将FeCl3溶液蒸干、灼烧,此过程中所涉及到的化学方程式是?。
(2)25℃时,向0.1 mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH减小,主要原因是?。
(3)某溶液中只存在OH-、H+、Na+、CH3COO-四种离子。
①若溶液中只溶解了一种溶质,该溶质的名称是?,该溶液中四种离子的浓度由大到小的顺序为?。
②若溶液中四种离子的大小顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则溶液中溶质的化学式为?。
③若溶液中c(Na+)=c(CH3COO-),则该溶液显?(填“酸性”、“碱性”、“中性”),该溶液由体积相等的稀NaOH和CH3COOH溶液混合而成,则混合前c(NaOH) ??c(CH3COOH)(填“>”、“<”或“=”)。
参考答案:(1)<,(1分)?Fe3+发生水解,加入盐酸后,抑制其水解。(2分)
FeCl3+3H2O Fe(OH)3+3HCl?或FeCl3+3H2O Fe(OH)3+3HCl?或FeCl3+3H2O Fe(OH)3↓+3HCl ↑( 2分 ) Fe(OH)3↓+3HCl ↑( 2分 )
2Fe(OH)3 Fe2O3+3H2O?(2分) Fe2O3+3H2O?(2分)
(2)氨水中存在电离平衡NH3·H2O NH4+ + OH-。NH4Cl溶于水,发生电离NH4Cl=NH4++Cl-,产生大量NH4+,使氨水的电离平衡向左移动,溶液中c(OH-)减小。(3分) NH4+ + OH-。NH4Cl溶于水,发生电离NH4Cl=NH4++Cl-,产生大量NH4+,使氨水的电离平衡向左移动,溶液中c(OH-)减小。(3分)
(3)① 醋酸钠? c(Na+)>c(CH3COO-)>c(OH-)>c(H+)?(每空1分,共2)
②NaOH、CH3COONa?(2分)?③中性,<?(每空1分,共2分))
本题解析:(1)氯化铁是强酸弱碱盐,溶于水铁离子水解溶液显酸性,因此常温时,FeCl3溶液的pH<7;氯化铁是强酸弱碱盐,溶于水铁离子水解溶液显酸性,加入盐酸后,抑制铁离子水解;水解是吸热的,加热促进水解。且生成的氯化氢极易挥发,因此最终得到氢氧化铁固体,进一步灼烧得到氧化铁,反应的反应式有FeCl3+3H2O Fe(OH)3+3HCl或FeCl3+3H2O Fe(OH)3+3HCl或FeCl3+3H2O Fe(OH)3↓+3HCl↑、2Fe(OH)3 Fe(OH)3↓+3HCl↑、2Fe(OH)3 Fe2O3+3H2O。 Fe2O3+3H2O。
(2)氨水中存在一水合氨的电离平衡NH3·H2O NH4+ + OH-。NH4Cl溶于水,发生电离NH4Cl=NH4++Cl-,产生大量NH4+,增大溶液中c(NH4+)浓度,使一水合氨的电离平衡向左移动,因此溶液中c(OH-)减小。 NH4+ + OH-。NH4Cl溶于水,发生电离NH4Cl=NH4++Cl-,产生大量NH4+,增大溶液中c(NH4+)浓度,使一水合氨的电离平衡向左移动,因此溶液中c(OH-)减小。
(3)①只有醋酸钠能同时电离出Na+、CH3COO-,而任何溶液中都存在水的电离平衡,所以若溶液中只溶解了一种溶质,该溶质的名称是醋酸钠。醋酸钠溶于水电离出的CH3COO-水解溶液显碱性,所以溶液中离子浓度大小关系是c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
②由于醋酸钠的水解程度比较小,所以若溶液中四种离子的大小顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+),这说明溶液是由醋酸钠和氢氧化钠组成的混合液,则溶液中溶质的化学式NaOH、CH3COONa。
③根据电荷守恒可知c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以若溶液中c(Na+)=c(CH3COO-),则溶液中c(OH-)=(H+),所以该溶液显中性。如果醋酸和氢氧化钠恰好中和生成醋酸钠,由于醋酸钠水解溶液显碱性。因此要使溶液显中性,则醋酸一定是过量的。因此若该溶液由体积相等的稀NaOH和CH3COOH溶液混合而成,则混合前c(NaOH)< c(CH3COOH)。
本题难度:一般
4、选择题 室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中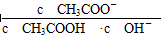 不变 不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
参考答案:B
本题解析:本题考查弱电解质的电离平衡,意在考查考生对电离平衡的理解和应用能力。醋酸溶液加水稀释后,CH3COOH的电离程度增大,n(H+)、n(CH3COO-)增大,A项错误;根据CH3COOH的电离平衡常数Ka=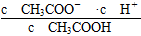 = = ,则 ,则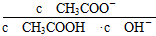 = =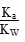 ,由于温度不变,Ka、KW均不变,因此 ,由于温度不变,Ka、KW均不变,因此 不变,B项正确;醋酸加水稀释,电离程度增大,n(H+)增大,但c(H+)减小,C项错误;再加入10 mL pH=11的NaOH溶液,反应后得到CH3COOH和CH3COONa的混合溶液,溶液显酸性,pH<7,D项错误。 不变,B项正确;醋酸加水稀释,电离程度增大,n(H+)增大,但c(H+)减小,C项错误;再加入10 mL pH=11的NaOH溶液,反应后得到CH3COOH和CH3COONa的混合溶液,溶液显酸性,pH<7,D项错误。
本题难度:一般
5、选择题 下面关于电解质的叙述正确的是 ( )
A.NaCl溶液能导电,所以NaCl溶液是电解质
B.若某种电解质溶液中含有未电离的分子,则该电解质一定是弱电解质
C.氯气和氨气的水溶液导电性都很好,所以它们是电解质
D.CaCO3在水中溶解度很小,但溶解的 CaCO3全部电离,所以 CaCO3是强电解质
|