| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《电解池原理》试题特训(2017年最新版)(二)
(5)铜的相对原子质量为:_______________________(用含有m、V的计算式表示)。 (6)如果用碱性(KOH为电解质)甲醇燃料电池作为电源进行实验,放电时负极的电极反应式为?。 参考答案:(1)负?(2)A极变粗,B极有气泡产生,溶液颜色变浅2Cu2++2H2O 本题解析:(1)测得O2的体积为VL,A极为负极, 本题难度:一般 2、选择题 下图装置可处理乙醛废水,乙醛在阴、阳极发生反应,分别转化为乙醇和乙酸。下列说法正确的是 |
参考答案:C
本题解析:A、b接电解池的阴极,故b为负极,错误;B、由于硫酸钠不参与电解反应,所以物质的量没有变化,错误;C、阳极失电子发生氧化反应,电极反应为CH3CHO-2e-+H2O CH3COOH+2H+,正确;D、电解的过程中,阳极生成氧气,阴极生成了氢气,错误;故本题选择C。
CH3COOH+2H+,正确;D、电解的过程中,阳极生成氧气,阴极生成了氢气,错误;故本题选择C。
考点:电解原理
本题难度:一般
3、选择题 用惰性电极电解下列各组中的三种电解质溶液,在电解的过程中,溶液的pH依次为升高、不变、降低的是(? )
A.AgNO3 CuCl2 Cu(NO3)2
B.KCl Na2SO4 CuSO4
C.CaCl2 KOH NaNO3
D.HCl HNO3 K2SO4
参考答案:B
本题解析:由电解规律可得:
类型
化学物质
pH变化
放O2生酸型
CuSO4、AgNO3、Cu(NO3)2
降低
放O2生酸型
KCl、CaCl2
升高
电解电解质型
CuCl2
升高
HCl
升高
电解H2O型
NaNO3、Na2SO4、K2SO4
不变
KaOH
升高
HNO3
降低
?
故选B。
本题难度:一般
4、填空题 如图所示,用石墨电极电解氯化铜溶液。查阅资料可知,CuCl42—显黄色,氯化铜溶液显蓝绿色或黄绿色;向体积相同浓度分别为0.01 mol/L、0.05 mol/L、0.1 mol/L、0.5 mol/L的氯化铜溶液中加入NaCl至饱和,对比发现,溶液的颜色由黄绿色向蓝绿色转变。
请回答下列问题:
(1)阳极上的气体呈________色,检验该气体可用________________。
(2)写出电解的离子方程式:________________。
(3)实验时,装置中阴极溶液颜色由蓝绿色变为黄绿色,原因是________。
(4)取出阴极的石墨棒,发现表面有浅蓝色固体,试设计实验探究此浅蓝色固体的成分:
____________________________________________________。
(5)为什么要设计连接后面的装置?
______________________________________________________________
参考答案:(1)黄绿色 湿润的淀粉-KI试纸 (2)Cu2++2Cl- Cu+Cl2↑
Cu+Cl2↑
(3)阴极Cu2+放电后,Cu2+与Cl-浓度比值减小
(4)取此浅蓝色固体于试管中,加入硫酸,若溶解且溶液变蓝色,则为Cu(OH)2
(5)因为阳极产生的氯气为有毒气体,故后面连接装置可以用于检验与吸收
本题解析:(1)阳极是阴离子放电,即Cl-放电产生Cl2,故颜色为黄绿色;检验Cl2可用湿润的淀粉-KI试纸,若试纸变蓝,则确定为氯气。(2)电解氯化铜的离子方程式为:Cu2++2Cl- ?Cu+Cl2↑。(3)由题目所给信息,Cu2+与Cl-浓度比值逐渐增大,溶液的颜色由黄绿色向蓝绿色转变,故阴极Cu2+放电后,Cu2+与Cl-浓度比值减小而呈现黄绿色。(4)随着反应的进行,Cu2+浓度降低,此时有一部分H+放电而使此区域OH-浓度增大,故此浅蓝色固体为Cu(OH)2。(5)电解氯化铜时产生的氯气有毒,故后面连接装置既可用作检验电解产生的气体,又可用于吸收该有毒气体。
?Cu+Cl2↑。(3)由题目所给信息,Cu2+与Cl-浓度比值逐渐增大,溶液的颜色由黄绿色向蓝绿色转变,故阴极Cu2+放电后,Cu2+与Cl-浓度比值减小而呈现黄绿色。(4)随着反应的进行,Cu2+浓度降低,此时有一部分H+放电而使此区域OH-浓度增大,故此浅蓝色固体为Cu(OH)2。(5)电解氯化铜时产生的氯气有毒,故后面连接装置既可用作检验电解产生的气体,又可用于吸收该有毒气体。
本题难度:一般
5、填空题 氯酸钾多用来制造火柴和烟花等。电解法是工业制造氯酸钾的主要方法:电解热的氯化钠水溶液,电解的生成物相互反应制得氯酸钠;再以氯酸钠和氯化钾为原料制备氯酸钾。
(1)写出电解时的电极反应方程式阴极:____________________________,阳极:_____________________________。
(2)电解的生成物相互反应生成氯酸钠的化学方程式为__________________________。
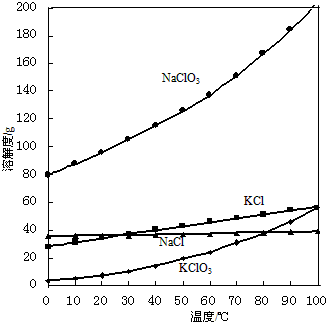
(3)几种物质的溶解度曲线如下图所示,低温有利于析出KClO3晶体,原因是:
_________________________________
(4)产品KClO3中常含有其他杂质离子,提纯的方法是_______________。
(5)该生产工艺可以循环利用的物质是__________,副产品是__________。
参考答案:(1)2H++2e-==H2↑;2Cl--2e-== Cl2↑
(2)3Cl2+6NaOH==NaClO3+5NaCl+3H2O
(3)KClO3的溶解度随温度降低而降低,低温时KClO3在四种物质中溶解度最小
(4)重结晶
(5)NaCl;H2
本题解析:
本题难度:困难
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学知识点整理《影响化学反.. | ||