微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下表为部分短周期元素的原子半径及主要化合价。下列说法正确的是
元素代号
| L
| M
| Q
| R
| T
|
原子半径/nm
| 0.186
| 0.143
| 0.104
| 0.075
| 0.066
|
主要化合价
| +1
| +3
| +6、-2
| +5、-3
| -2
|
A.气态氢化物的稳定性:R>T
B.工业上电解MCl3溶液制备单质M
C.化合物L2T与QT2所含化学键类型相同
D.L与Q的最高价氧化物对应水化物均能与M(OH)3反应
参考答案:D
本题解析:由图中已知条件可得,L、M、Q为第三周期元素,R、T为第二周期元素。A、R、T两种元素处于同周期,非金属性依次增强,气态氰化物的稳定性依次增强,错误;B、由已知条件可知,M为金属铝,工业上用电解熔融Al2O3的方法制备单质铝,错误;C、化合物L2T为Na2O,QT2为SO2,所含化学键类型不同,错误;D、 L与Q的最高价氧化物对应水化物分别为氢氧化钠和硫酸,都可以和Al(OH)3反应,正确;故本题选择D。
考点:元素周期律的应用
本题难度:困难
2、填空题 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色硫酸盐溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成。请回答下列问题:
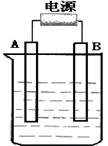
(1)请写出B极板的名称:??电极反应式?
写出电解时反应的总离子方程式?
(2)若当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。电解后溶液的pH为?;要使电解后溶液恢复到电解前的状态,则需加入?,其质量为?g。(假设电解前后溶液的体积不变)
(3)若原溶液为1L? K2SO4、CuSO4的混合溶液,且c(SO42-)=" 2.0mol/L" ;如图装置电解,当两极都收集到22.4L气体(标准状况)时,停止电解。
则原溶液中的c(K+)=?
参考答案:(1)阳极(2分)4OH-- 4e-=2H2O+O2 ↑(2分)、
电解
本题解析:略
本题难度:简单
3、填空题 (9分)
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
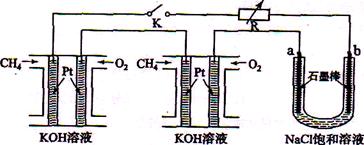
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为 、 。
(2)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是 ,电解氯化钠溶液的总反应方程式为 ;
(3)若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量为
(法拉第常数F=9.65×l04C.mol-1,列式计算),最多能产生的氯气体积为 L(标准状况)。
参考答案::(1)O2+2H2O +4e—=4OH—,CH4+10OH--8e—=CO32-+ 7H2O;(2)H2;2NaCl+2H2O 2NaOH+ H2↑+ Cl2↑;(3)(1L/22.4L.mol-1)×8×9.65× 104C.mol-1 =3.45×104C;4。
2NaOH+ H2↑+ Cl2↑;(3)(1L/22.4L.mol-1)×8×9.65× 104C.mol-1 =3.45×104C;4。
本题解析::(1)燃料电池的总反应就是燃料燃烧的反应即:CH4+2O2+2OH- = CO32-+ 3H2O,故其正极反应式为:O2+ 2H2O +4e—= 4OH—,我们用总反应式减正极反应式可得负极反应式:CH4+10OH--8e—=CO32-+ 7H2O;(2分析图中三池可看出1、2两池是串联的燃料电池,通入甲烷的一极是负极,故此电解池中与其相连的b电极为阴极,生成的气体为氢气;电解的总反应式为:2NaCl+2H2O 2NaOH+ H2↑+ Cl2↑;(3)根据(1)中的负极反应式,可知通入1mol甲烷时失电子8mol,总电量为8×96500C,由于图中的两个电池是串联,故可知线路上转移的电子与一个燃料电池时相同,结合甲烷的量,其1L为1/22.4mol,可求电为:(1L/22.4L.mol-1)×8×9.65× 104C.mol-1 =3.45×104C;电解时得到氢气为4L。
2NaOH+ H2↑+ Cl2↑;(3)根据(1)中的负极反应式,可知通入1mol甲烷时失电子8mol,总电量为8×96500C,由于图中的两个电池是串联,故可知线路上转移的电子与一个燃料电池时相同,结合甲烷的量,其1L为1/22.4mol,可求电为:(1L/22.4L.mol-1)×8×9.65× 104C.mol-1 =3.45×104C;电解时得到氢气为4L。
【考点定位】此题以燃料电池的使用为载体,考查了原电池的电极反应式书写、电极的判断和电解知识。
本题难度:一般
4、选择题 下图为某化工厂用石墨电解Na2CrO4溶液制备Na2Cr2O7的模拟装置,下列有关说法错误的是:

A.溶液中OH-由阴极区流向阳极区
B.阳极区产生的气体与阴极区产生的气体在相同状况下体积之比为1:2
C.阳极的电极反应式为:2H2O-4e-=O2↑+4H+
D.Na2CrO4转化为Na2Cr2O7的离子方程式为:2CrO42-+2H+= Cr2O72-+H2O
参考答案:A
本题解析:通过电解提高阳极区溶液的酸性,说明在阳极区生成H+,电极反应式为2H2O-4e-=O2+4H+,2CrO42-+2H+=Cr2O72-+H2O;溶液PH不会不断下降,中间有钠离子交换膜,溶液中OH-不能由阴极区流向阳极区,故A错误,故选A。
本题难度:一般
5、填空题 (12分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理,常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
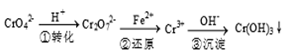
其中第①步存在下列平衡:2CrO42- (黄色) +2H+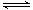 Cr2O72-(橙色) +H2O
Cr2O72-(橙色) +H2O
(1)若平衡体系的pH=2,该溶液显 色。
(2)能说明第①步反应达平衡状态的是 。
A.Cr2O72-和CrO42-的浓度相同
B.2V(Cr2O72-)=V(CrO42-)
C.溶液的颜色不变
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡
Cr(OH)3(s) 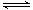 Cr3+(aq)+3OH-(aq) Ksp Cr(OH)3="c" (Cr3+)?c3(OH-)=10-32
Cr3+(aq)+3OH-(aq) Ksp Cr(OH)3="c" (Cr3+)?c3(OH-)=10-32
常温下,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至__________。
方法2电解法:
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的原因为 。
(5)在阴极附近溶液pH升高的原因(用电极反应式解释) ,溶液中同时生成的沉淀还有 。
参考答案:(1)橙色;(2) C;(3) 5;(4) 提供Fe2+作还原剂;(5) 2H++2e-=H2↑;Fe(OH)3
本题解析:(1)根据平衡移动原理:若平衡体系的pH=2,该溶液显强酸性,在酸性环境,平衡正向移动,因此溶液呈橙色;(2)A.Cr2O72-和CrO42-的浓度相同,溶液可能处于平衡状态,也可能处于非平衡状态,错误;B.在任何状态,都存在:V(Cr2O72-):V(CrO42-)=1:2;即V(CrO42-)=2V(Cr2O72-),因此不能说明该反应处于平衡状态,错误;C.若反应未达到平衡状态,则溶液的颜色会发生改变,因此溶液的颜色不变能说明第①步反应达平衡状态,正确;(3)Ksp Cr(OH)3="c" (Cr3+)?c3(OH-)=10-32,由于c(Cr3+)= 10-5mol/L,所以c3(OH-)=10-32÷10-5=10-27。c (OH-)=10-9;由于在溶液中存在水的电离平衡,c(H+)=10-5 mol/L。所以溶液的pH=5;该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。(4)用Fe做电极的原因为Fe作阳极发生氧化反应:Fe-2e-=Fe2+;Cr2O72-与Fe2+会发生氧化还原反应产生Cr3+;(5)溶液中的阳离子的放电能力:H+>Fe3+;在阴极上H+得到电子发生反应:2H++2e-=H2↑;使溶液中c(OH-)增大,所以阴极附近溶液pH升高;Fe3++3OH-= Fe(OH)3↓,所以溶液中同时生成的沉淀还有Fe(OH)3。
考点:考查化学平衡移动、反应平衡状态的判断、沉淀溶解平衡的应用、电解原理在污水处理的应用。
本题难度:困难