微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 有一固体样品,其中只含有Na2CO3·10H2O和NaHCO3.为了测定样品中Na2CO3的质量分数,请从下图中选用适当的实验装置,设计一个最简单的实验,测定固体样品中Na2CO3的质量分数。
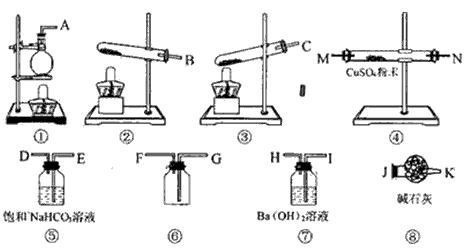
请填写下列各空:
(1)应选用的装置是(只写装置的代号,装置不重复)_________________,所选用装置的连接顺序是(填接口的字母):_______接_______,_______接_______,_______接_______ ……。
(2)装置⑥中应盛放的试剂是__________________,其作用是_____________________。
(3)选用的装置连接好后,最后一个装置的作用是_______________________________。
(4)写出吸收CO2的离子方程式____________________________________。
(5)停止加热时,正确的操作是____________________________________。
(6)取m g固体样品实验,经测定m g固体样品在加热时,完全分解,可得agCO2,则m g样品中所含。
Na2CO3的质量分数为________________________________。(用含m、a的代数式表示)
参考答案:(1)②⑥⑦⑧; B; G;F; I;H ;J
(2)浓H2SO4 ; 吸收反应生成的水
(3)防止Ba(OH)2溶液吸收空气中的CO2,造成实验误差
(4)Ba2++2OH-+CO2=BaCO3+H2O
(5)先将连接② ⑥装置的橡皮管卸下后,再撤去酒精灯
(6)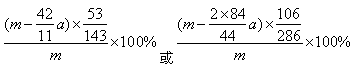
本题解析:
本题难度:一般
2、实验题 铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验
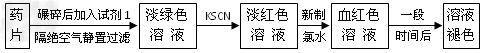
⑴试剂1是_____________。
⑵加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是
________________________。
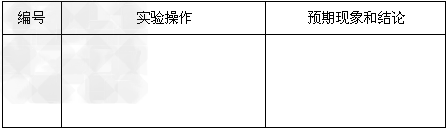
⑶在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想

基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。(不一定填满,也可以补充)
⑷另一同学为了检测“速力菲”药片中铁的含量,设计并进行了如下实验:
①取样、碾碎,并称取2.0g,加入过量盐酸,搅拌使其完全溶解;
②向所得溶液中先加入足量H2O2溶液,再加入足量氨水,充分反应后过滤并洗涤沉淀;
③将所得固体灼烧至恒重,得0.8g红棕色固体。
④计算:“速力菲”药片中铁的质量分数为____________。
参考答案:⑴稀盐酸(或稀硫酸溶液)?
⑵Fe2+被空气中氧气氧化成Fe3+⑶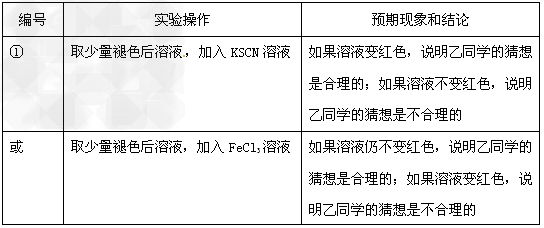 ⑷28%
⑷28%
本题解析:
本题难度:一般
3、实验题 明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示
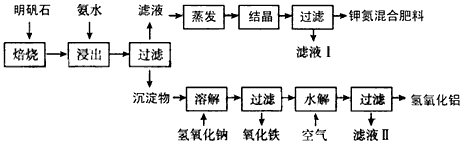
根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出,需要480 mL0.1mol/L稀氨水。现用6mol/L浓氨水配制该稀氨水需要用到的仪器有_________ (胶头滴管、量筒、烧杯、玻璃棒、碱式滴定管)。
(2)氨水浸出后得到固液混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+。检验NH4+的方法是
_________________
(3)蒸发需用到的仪器除酒精灯和夹持仪器外还需要_________。
A.坩埚、坩埚钳、玻璃棒
B.蒸发皿、玻璃棒
C.烧杯、玻璃棒
D.蒸馏烧瓶、冷凝管、锥形瓶
(4)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取mg钾氮混合肥试样并溶于水,加入足量BaCl2溶液,产生白色沉淀。
②过滤、____、____(依次填写实验操作名称)。
③冷却、称量该沉淀质量为a g。
④计算。由以上实验数据计算得K2SO4的物质的量为n mol,则该钾氮混合肥中钾的质量分数为______
(用字母表示)。
参考答案:(1)500 mL容量瓶
(2)取滤液少许,加入NaOH,加热,生成的气体能使湿润的红色石蕊试纸变蓝
(3)B
(4)②洗涤;干燥;④78n/m×100%
本题解析:
本题难度:一般
4、选择题 下列装置或操作不能达到实验目的的是
[? ]
A.利用排空气法收集CO2?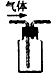
B.实验室制取NH3
C.实验室制取Fe(OH)2? 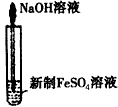
D.实验室制乙酸乙酯? 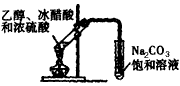
参考答案:D
本题解析:
本题难度:一般
5、简答题 某校的研究性学习小组进行测定混合物各组分质量比的研究,甲、乙、丙三位同学各设计了一种实验方案如下表所示:(混合物的质量事先已称量好)
实验
序号 |
混合物 | 第一步:
加入适量水,充分溶解 | 第二步:
加入或通入的试剂 | 第三步:
过滤后洗涤干燥所得固体 | 第四步:
蒸发滤液得到晶体 | 第五步:
称量,记录数据
甲
BaCl2
NaCl
澄清溶液
过量CO2
无固体
晶体
称量所得晶体
乙
CaCl2
NaCl
澄清溶液
过量饱和Na2CO3溶液
CaCO3
NaCl
称量蒸发所得晶体
丙
Na2SO4
MgSO4
澄清溶液
过量NaOH溶液
______
______
______
|
试回答下列问题:
①你认为甲同学设计的实验步骤中,根据称量所得到的数据,______?(填“能”或“不能”)准确计算得出混合物中各组分的质量比.
②经讨论大家认为,乙同学所设计的实验步骤的第四步填写一定有错误.其理由是______.
③丙同学对实验进行了设计,请将其后三步正确的内容仿照前面的形式填入对应的空格内.
参考答案:①二氧化碳通入溶液中和氯化钡、氯化钠不反应,蒸干溶液得到溶质固体仍为氯化钡和氯化钠固体,不能计算;
故答案为:不能;
?②混合物溶解后加入过量的碳酸钠溶液,钙离子完全沉淀,蒸发结晶得到固体为氯化钠和碳酸钠混合物,称量固体质量不能计算原混合物成分质量;
故答案为:第二步加入的碳酸钠溶液为过量的,最后所得晶体中应有碳酸钠存在;
③硫酸镁和硫酸钠混合物溶于水后加入过量氢氧化钠溶液,镁离子完全沉淀,过滤后的溶液蒸发结晶得到溶质固体为氢氧化钠和硫酸钠,称量氢氧化镁沉淀质量换算物质的量可以计算得到硫酸镁质量和硫酸钠质量;故答案为:丙Mg(OH)2NaOH?Na2SO4称量过滤后所得?Mg(OH)2固体
本题解析:
本题难度:一般