微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (1)某研究性学习小组利用所学知识进行下列实验研究.如图I所示(导管出口高于液而)请回答下列问题:?
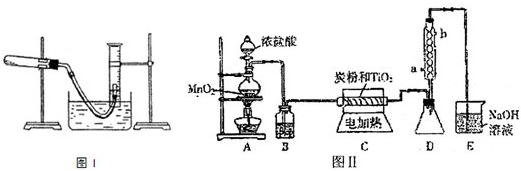
①测量收集到气体的体积必须包括的几个步骤:a.调整量筒内外液面高度使之相同;b.使试管和量筒内的气体都冷却至室温;c.读取量筒内气体的体积.这三步操作的正确顺序是:______(请填写步骤代号).
②测量收集到气体体积时,如何使量筒内外液面的高度相同?______.
(2)在图I中利用高锰酸钾分解制氧气,为了得到二氧化锰,实验完毕将图I中的试管冷却后,把剩余的药品倒入烧杯中加水溶解,再经过滤、洗涤和干燥得到纯净的二氧化锰.“过滤”装置中使用的玻璃仪器除烧杯外还有______.?
(3)图II是实验室制取TiCl4的装置.四氯化钛是无色液体,沸点为136℃.它极易水解,遇空气中的水蒸汽即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl).在650℃~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和CO气体.
①A装置中反应的离子方程式______
②B装置中的试剂及其作用是______,______?
③D装置中冷凝水的方向为______进______出(填字母)?
④请指出此装置的缺陷和不妥之处?
| 编号 | 装置的缺陷和不妥之处
|
| a | ______?
|
| b | ______
|
| … | ______
参考答案:(1)①读取量筒内气体的体积,肯定是最后一步,使试管和量筒内的气体都冷却至室温,否则装置中的气体处于受热膨胀状态,体积会偏大,接下来为了能够读取量筒内气体的体积,要调整量筒内外液面高度使之相同,故答案为:bac;
②试管和量筒内的气体都冷却后,量筒内的液面一定高于量筒外的液面,慢慢将量筒下移,量筒上方气体体积减小,压强增大,当量筒内气体压强等于外界大气压时,量筒内液面和水槽内液面相平.故答案为:慢慢将量筒下移;
(2)因过滤装置需要的仪器有铁架台、普通漏斗和烧杯,使用的玻璃仪器除烧杯外还有普通漏斗,故答案为:普通漏斗;
(3)①实验室用二氧化锰和浓盐酸反应制氯气:MnO2+4HCl(浓)?加热?.?MnCl2+Cl2 ↑+2H2O,离子方程式为:MnO2+4H++2Cl-?加热?.?Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-?加热?.?Mn2++Cl2↑+2H2O;
②因制备的氯气中含有杂质氯化氢和水蒸气,可用浓硫酸来除去,故答案为:浓硫酸;干燥氯气;
③因根据冷凝管内的水流方向由下向上,即a进b出,因为这样可以提高冷凝效果,故答案为:a;b;
④a、因TiCl4 遇空气中水蒸气发生水解,缺少阻止水蒸气进入D的装置,故答案为:TiCl4 遇空气中水蒸气发生水解,缺少阻止水蒸气进入D的装置;
b、因TiCl4 水解产生的氯化氢极易溶于水,需要加上防倒吸的装置,故答案为:TiCl4 水解产生的氯化氢极易溶于水,需要加上防倒吸的装置;
c、因氯气通过二氧化钛和炭粉的混合物得到的CO气体有毒,缺少CO的处理装置,故答案为:由于CO气体有毒,缺少CO的处理装置.
本题解析:
本题难度:一般
2、简答题 为了除去粗盐中Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)

(1)判断BaCl2已过量的方法是______;
(2)第④步中,相关的离子程式是______;
(3)若先用盐酸调PH再过滤,会对实验结果有影响吗?______(填“有”或“无”),试分析原因:______.
参考答案:(1)在粗盐提纯时,加入过量的氯化钡的目的是除去硫酸根离子,并将之除尽,氯化钡过量时,加入硫酸会产生白色沉淀,可以通过检验钡离子来确定氯化钡是否过量,所以取所得溶液的上层清液1~2滴于滴定板上,再滴入1~2滴BaCl2溶液,若溶液未变浑浊,表明BaCl2已过量,
故答案为:取所得溶液的上层清液1~2滴于滴定板上,再滴入1~2滴BaCl2溶液,若溶液未变浑浊,表明BaCl2已过量
(2)粗盐的提纯中,加入碳酸钠的作用是除去杂质离子钙离子以及过量的钡离子,反应的方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl,BaCl2+Na2CO3=BaCO3↓+2NaCl,反应的实质是:Ca2++CO32-=CaCO3↓;Ba2++CO32-=BaCO3↓,
故答案为:Ca2++CO32-=CaCO3↓;Ba2++CO32-=BaCO3↓;
(3)若先用盐酸调pH再过滤,那样Mg(OH)2、CaCO3、BaCO3会与盐酸反应,生成易溶于水的氯化镁、氯化钙、氯化钡等物质,从而影响氯化钠的纯度,
故答案为:有,在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度;
本题解析:
本题难度:一般
3、实验题 已知某种燃料含有碳、氢、氧3种元素。为了测定这种燃料中碳和氢2种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过下图所示装置,得到如下表所列的实验数据(假设产生的气体完全被吸收)。
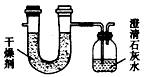

根据实验数据填空:
(1)实验完毕后,生成物中水的质量为__________g,假设广口瓶里生成1种正盐,其质量为________ g。
(2)生成的水中氢元素的质量为______________g。
(3)生成的CO2中碳元素的质量为____________g。
(4)该燃料中碳、氢元素质量比为____________。
(5)已知这种燃料的每个分子中只有1个氧原子,则该燃料的分子式为________,结构简式为__________。
参考答案:(1)1.8;5
(2)0.2
(3)0.6
(4)3:1
(5)CH4O;CH3OH
本题解析:
本题难度:一般
4、选择题 有关图及实验的描述正确的是( )
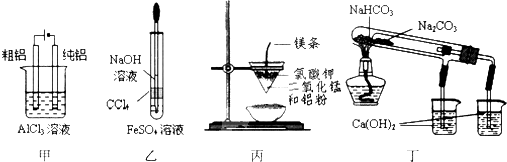
A.用甲图装置电解精炼铝
B.用乙图装置制备Fe(OH)2
C.丙图装置可制得金属锰,用同样的装置可制得金属铬
D.丁图验证NaHCO3和Na2CO3热稳定性
参考答案:C
本题解析:
本题难度:简单
5、选择题 关于下列实验装置或操作的说法中,正确的是( )
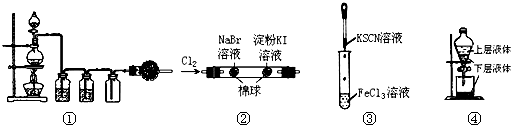
A.①可用于实验室用MnO2固体与浓盐酸共热,制取并收集干燥、纯净的Cl2
B.②实验中若左边棉花变橙色,右边棉花变蓝色,则能证明氧化性:Cl2>Br2>I2
C.③实验试管中会生成血红色沉淀
D.用图④操作可提取碘水中的碘
参考答案:A
本题解析:
本题难度:一般
|