微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验发现,298 K时,在FeCl3酸性溶液中加入少量锌粒后,Fe3+立即被还原成Fe2+。某化学兴趣小组根据该实验事实设计了如图所示的原电池装置。下列有关说法中正确的是? ( )
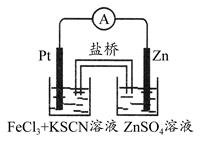
A.该原电池的正极反应是:Zn-2e-=Zn2+
B.左烧杯中溶液的红色逐渐褪去
C.该电池铂电极上有气泡出现
D.该电池总反应为:3Zn+2Fe3+=2Fe+3Zn2+
参考答案:B
本题解析:正极是得电子的反应,A错误;左烧杯中的电极反应式为Fe3++e-=Fe2+,B正确、C错误;因为在金属活动性顺序中铁排在H的前面,在酸性溶液中不会生成Fe,D错误。
本题难度:一般
2、选择题 下列有关说法正确的是
A.汽车尾气的净化反应2NO+2CO 2CO2+N2△H<0,则该反应一定能自发进行
2CO2+N2△H<0,则该反应一定能自发进行
B.电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属
C.由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀
D.对N2(g)+3H2(g) 2NH3(g),其他条件不变时充入N2,正逆反应速率均增大
2NH3(g),其他条件不变时充入N2,正逆反应速率均增大
参考答案:D
本题解析:A、该反应熵变小于零(反应气体体积减少),焓变小于零,反应可能自发,错误;B、电解过程中Zn、Fe失去电子变为阳离子进入溶液,错误;C、可以通过高浓度的碳酸根离子逆向转化,错误;D、正反应速率和逆反应速率均增大,正确。
本题难度:一般
3、选择题 下列各装置中铜电极上能产生气泡的是( )。
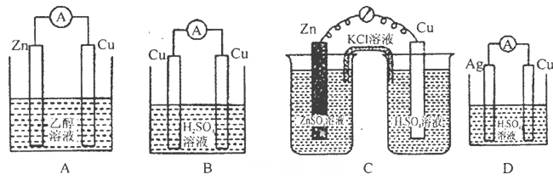
参考答案:C
本题解析:A、,溶液不是电解质溶液,不能形成原电池,错误;B、两极材料相同,不能形成原电池,铜上无气泡,错误;C、原电池装置,铜作正极,H+放电成为氢气,正确;D、不能构成原电池,不存在氧化还原反应,错误,答案选C。
考点:考查原电池的形成条件
本题难度:一般
4、选择题 将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,即构成甲烷燃料电池,已知通入甲烷的一极,其电极反应为CH4+10OH--8e-==== +7H2O;通入氧气的另一极,其电极反应式是2O2+4H2O+8e-====8OH-,下列叙述正确的是(?)
+7H2O;通入氧气的另一极,其电极反应式是2O2+4H2O+8e-====8OH-,下列叙述正确的是(?)
A.通入甲烷的电极为正极
B.正极发生氧化反应
C.该电池使用一段时间后应补充氢氧化钾
D.燃料电池工作时,溶液中的阴离子向正极移动
参考答案:C
本题解析:依据原电池原理,负极发生氧化反应,正极发生还原反应,确定A不正确;由于CH4被氧化成CO2,要消耗KOH,故应不断补充KOH。
本题难度:一般
5、计算题 按下图装置进行实验,并回答下列问题
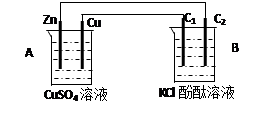
(1)判断装置的名称:B池为
(2)铜极为______极,电极反应式为
石墨棒C2附近发生的实验现象为
(3)当C2极析出224mL气体(标准状态时,锌的质量变化(增加或减少) g.
CuSO4溶液的质量变化了(增加或减少了) g .
参考答案:(共9分,前3空每空1分,其余各2分)
(1) 电解池 (2)正 Cu2+ + 2e- = Cu 有气泡冒出,溶液变红
(3)减少 0.65 增加 0.01
本题解析:(1)锌能和硫酸铜发生置换反应,所以根据装置结构特点可知,A是原电池,则B就是电解池。
(2)铜是正极,溶液中的铜离子得到电子,电极反应式是Cu2+ + 2e- = Cu。石墨棒C2和电源的负极相连,做阴极,溶液中的氢离子放电,同时破坏溶液中水的电离平衡,使阴极周围溶液显碱性,所以附近发生的实验现象为有气泡冒出,溶液变红。
(3)224ml气体是氢气,物质的量是0.01mol,则转移0.02mol电子,所以根据电子的得失守恒可知,消耗锌的物质的量是0.02mol÷2=0.01mol,质量是0.65g,即锌的质量减少0.65g。由于正极析出铜的质量是0.64g,所以溶液质量增加0.65g-0.64g=0.01g。
考点:考查原电池和电解池的有关判断和计算
点评:该题是中等难度的试题,也是高考中的常见考点,试题基础性强,难易适中。主要是考查学生对电化学原理的了解掌握程度,有助于培养学生的逻辑思维能力,提高学生分析问题、特别是灵活运用基础知识解决实际问题的能力。
本题难度:一般