微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列装置工作时实现化学能转化为电能的是( )
A.干电池
B.光伏电池
C.离子交换膜电解槽
D.风力发电机
参考答案:A.干电池属于原电池,是将化学能转化为电能的装置,故A正确;
B.光伏电池是将光能转化为电能的装置,故B错误;
C.离子交换膜电解槽是将电能转化为化学能的装置,属于电解池,故C错误;
D.风力发电机是将动能转化为电能的装置,故D错误;
故选A.
本题解析:
本题难度:简单
2、选择题 下列说法中,正确的是(?)
A.原电池是将电能转化为化学能的装置
B.在原电池中,负极上发生氧化反应
C.在原电池中,电子从原电池的正极流向负极
D.由于生铁中含有碳,所以生铁比纯铁耐腐蚀
参考答案:B
本题解析:A不正确,原电池是将化学能转化为电能的装置。在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。所以B正确,C不正确。生铁中含有碳,易形成原电池加快腐蚀,D不正确,答案选B。
本题难度:一般
3、填空题 (16分)“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式,并在方框内填上系数。
□C+□KMnO4+□H2SO4=□CO2↑+□MnSO4 +□K2SO4+□
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)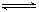 CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
实验组
| 温度℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
CO
| H2O
| H2
| CO
|
1
| 650
| 4
| 2
| 1.6
| 2.4
| 6
|
2
| 900
| 2
| 1
| 0.4
| 1.6
| 3
|
①实验1条件下,反应从开始至达到平衡,以v(CO2)表示的反应速率为 (保留小数点后二位数,下同)。
②实验2条件下平衡常数K= ,该反应为 (填“吸热”或“放热”)反应。
(3)已知在常温常压下:
①2CH3OH(l) +3O2(g)=2CO2(g)+4H2O(g) ΔH1=-1275.6 kJ/mol
②2CO (g)+ O2(g)=2CO2(g) ΔH2=-566.0 kJ/mol
③H2O(g)=H2O(l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式: 。
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
该电池正极的电极反应式为 ;该电池工作时,溶液中的OH-向 (填“正”或“负”)极移动。
参考答案:(1)5C+4KMnO4 +6 H2SO4=5CO2↑+4MnSO4+2K2SO4+6H2O (3分)
(2)①0.13mol/(L·min) (2分) ②0.17(2分); 放热(2分)
(3)CH3OH(l)+O2(g)= CO(g)+2H2O(g) ΔH=-354.8KJ/mol(3分)
(4)①O2 + 4e- + 2 H2O = 4OH—(2分) ②负(2分)
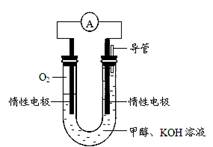
本题解析:(1)高锰酸钾中锰元素化合价降低(+7)-(+2)=5价,碳元素化合价升高0-(-4)=4价,化合价升降守恒,所以高锰酸钾前的系数是4,碳单质前的系数是5,根据原子守恒,二氧化碳前是5,硫酸锰前是4,硫酸钾前面是2,根据硫酸跟守恒,所以硫酸前面是6,据氧原子和氢原子守恒,产物少6个水分子,故方程式为:5C+4KMnO4 +6 H2SO4=5CO2↑+4MnSO4+2K2SO4+6H2O;(2)①、由表中数据可知,CO的物质的量变化量为4mol-2.4mol=1.6mol,v(CO)=1.6mol÷2L÷6min=0.13mol/(L·min);速率之比等于化学计量数之比,故v(CO2)=v(CO)=0.13mol/(L?min);③、平衡时CO的物质的量为1.6mol,则可列三段式
CO(g)+ H2O(g)? CO2(g)+ H2(g),
开始(mol):2 1 0 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
该反应前后气体体积不变,故利用物质的量代替浓度计算平衡常数,故900℃时该反应平衡常数k=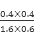 =0.17,则该反应为放热反应(2)已知:①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1)△H=-1275.6kJ/mol,②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol,③ H2O(g)=H2O(l) ΔH3=-44.0 kJ/mol根据盖斯定律,①-②得2CH3OH(1)+2O2(g)=2CO(g)+4H2O(g),故△H=(-1275.6kJ/mol)-(-566.0kJ/mol)="-709.6" kJ/mol即CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-354.8kJ/mol,(3)①电池反应原理甲醇发生氧化反应,在负极放电,氧气发生还原反应,在正极放电,反应式为O2+4e-+2H2O=4OH-,②负极失电子产生大量正电荷,则该电池工作时,溶液中的OH-向负极。
=0.17,则该反应为放热反应(2)已知:①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1)△H=-1275.6kJ/mol,②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol,③ H2O(g)=H2O(l) ΔH3=-44.0 kJ/mol根据盖斯定律,①-②得2CH3OH(1)+2O2(g)=2CO(g)+4H2O(g),故△H=(-1275.6kJ/mol)-(-566.0kJ/mol)="-709.6" kJ/mol即CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-354.8kJ/mol,(3)①电池反应原理甲醇发生氧化反应,在负极放电,氧气发生还原反应,在正极放电,反应式为O2+4e-+2H2O=4OH-,②负极失电子产生大量正电荷,则该电池工作时,溶液中的OH-向负极。
考点:化学反应原理。
本题难度:一般
4、选择题 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法不正确的是
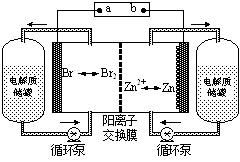
A.充电时电极a连接电源的负极
B.放电时负极的电极反应式为Zn—2e-=Zn2+
C.放电时左侧电解质储罐中的离子总浓度增大
D.阳离子交换膜可阻止Br2与Zn直接发生反应
参考答案:A
本题解析:
试题分析;在充电时,是电能转化为了化学能,相当于是电解池。而在放电时,是化学能转化为电能,相当于是原电池。原电池的正极,连接电解池的阳极,而电解池的阳极链接电源的正极,在电解池中,阴离子向阳极一定,由溴离子向左边移动可知,a应连接原电池的正极。所以A选项是错误的。b应连接原电池的负极,因此在放电时。负极的电极反应式为Zn—2e-=Zn2+故B选项是正确的。C选项,放电时,左侧做正极,放电相当于原电池,因此阳离子向正极反应方向进行,而阳离子交换膜只允许阳离子通过,所以左侧的离子浓度会增大。故C选项是正确的。D选项,阳离子交换膜只允许阳离子通过,因此D选项是正确的。
本题难度:一般
5、选择题 下图为一电化学综合实验装置。其中装置D为用加有酚酞的淀粉碘化钾溶液湿润的长条滤纸,c、d为Pt片。整套装置工作一段时间后,发现Pt片d的周围变为蓝色。下列有关说法错误的是?
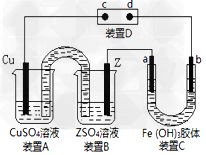
[? ]
A.Pt片c上发生的反应为2H++2e-=H2↑,c周围变为红色
B.b电极的周围的颜色变深,说明Fe(OH)3胶粒带有正电
C.Z单质的金属活动性较Cu强
D.装置A、B之间倒置的U型管,是沟通两装置的离子通道
参考答案:C
本题解析:
本题难度:一般