微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某 课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式为:
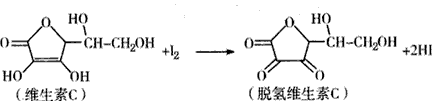
下列说法正确的是
[? ]
A.上述反应为取代反应
B.滴定时可用淀粉溶液作指示剂
C.滴定时应剧烈振荡锥形瓶
D.脱氢维生素C的分子式为C6H5O6
参考答案:B
本题解析:
本题难度:一般
2、实验题 (1)食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量K+、Ca2+ 、Mg2+、SO42-?等杂质离子,实验室提纯NaCl的流程如下:
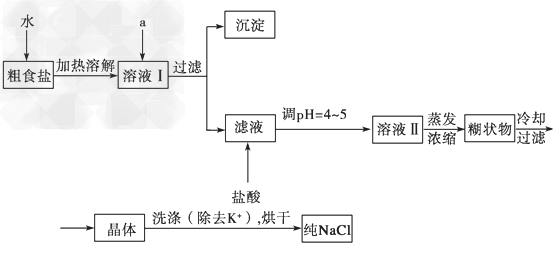
提供的试剂:?饱和Na2CO3溶液?饱和K2CO3溶液?NaOH溶液?BaCl2溶液?Ba(NO3)2溶液?75%乙醇?四氯化碳
①欲除去溶液Ⅰ中的Ca2+ 、Mg2+ 、SO42-?离子,选出a所代表的试剂,按滴加顺序依次为_____________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_____________。
(2)用提纯的NaCl配制500?mL?4.00?mol·L-1 NaCl溶液,所用仪器除药匙、托盘天平、烧杯、玻璃棒外还有_______________(填仪器名称)。
参考答案:(1)①BaCl2、NaOH、Na2CO3? ;?②75%乙醇?
(2)500?mL容量瓶、胶头滴管
本题解析:
本题难度:一般
3、选择题 利用下列实验装置能完成相应实验的是?
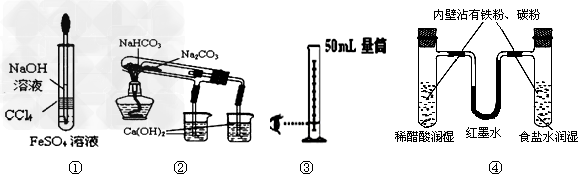
[? ]
A.装置①制备Fe(OH)2?
B.装置②验证NaHCO3和Na2CO3热稳定性
C.装置③量取8.5mL的稀硫酸?
D.装置④模拟铁的腐蚀?
参考答案:D
本题解析:
本题难度:一般
4、填空题 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
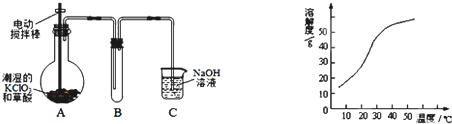
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:?.
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、?;B也必须添加温度控制装置,应该是?(填“冰水浴”或“热水浴”)装置.
(3)反应后在装置C中可得NaClO2溶液.已知N aClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2?3H2O,在温度高于38℃时析出晶体是NaClO2.根据如图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2的操作步骤:
①?;②?;③洗涤;④干燥.
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液.为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.00mL试样;量取V1mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c?mol?L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL.(已知2Na2S2O3+I2═Na2S4O6+2NaI)
①滴定过程中,至少须进行两次平行测定的原因是?.
②原ClO2溶液的浓度为?g?L-1(用步骤中的字母代数式表示).
参考答案:
本题解析:
本题难度:一般
5、简答题 三种可溶性物质A、B、C,其中有一种是碱,两种是盐,它们溶于水后电离产生Na+、H+、Ba2+、OH-、CO32-、SO42-六种离子.为鉴别它们,分别完成以下实验.请根据实验的结果回答问题:
(1)A溶液与B溶液反应可生成气体X.根据上述六种离子之间的可能反应判断X的化学式为______,A溶液与B溶液反应的离子方程式为______.
(2)气体X可以和C溶液反应生成沉淀D,沉淀D可与B溶液反应.则A的化学式为______,B的化学式为______,C的化学式为______.
(3)B溶液与C溶液反应生成不溶于稀硝酸的白色沉淀E.B溶液与C溶液反应至中性的离子方程式为______.
(4)D与E的混合物43g,加入足量盐酸,完全反应生成的气体2.24L(标准状况),则E在混合物中的质量分数为______.
参考答案:(1)生成的气体只有CO2符合,发生的反应为 2H++CO32-=H2O+CO2↑;
故答案为:CO2; 2H++CO32-=H2O+CO2↑;
(2)CO2气体可以和C溶液反应生成沉淀D,则C为Ba(OH)2,沉淀D为BaCO3,与B溶液反应,则B为NaHSO4,所以A为Na2CO3,在溶液中完全电离生成Na+、H+和SO42-,电离方程式为NaHSO4=Na++H++SO42-,检验SO42-时,取B溶液少量,先加盐酸,无明显现象,再加BaCl2溶液产生白色沉淀,
故答案为:Na2CO3,NaHSO4,Ba(OH)2;
(3)B为NaHSO4,C为Ba(OH)2,B溶液与C溶液反应生成不溶于稀硝酸的白色沉淀E为BaSO4,B溶液与C溶液反应至中性的离子方程式为:
2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓,
故答案为:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓;
(4)D为BaCO3与E为BaSO4的混合物43g,加入足量盐酸,发生的反应为BaCO3+2HCl=CO2↑+BaCl2+H2O,生成二氧化碳物质的量
n(CO2)=2.24L22.4L/mol=0.1mol,
n(BaCO3)=n(CO2)=0.1mol,
m(BaCO3)=0.1mol×197g/mol=19.7g,
m(BaSO4)=43g-19.7g=23.3g,
所以:w(BaSO4)=23.3g43g×100%=54.18%,
故答案为:54.18%;
本题解析:
本题难度:一般