微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在pH=1溶液中能大量共存的离子组是
A.MnO4-、OH?、SO42-、Cl-?
B.Fe2+、K+、NO3-、Al3+
C.NH4+、Cu2+、SO42-、Cl-?
D.Na+、Ca2+、Cl?、HCO3-
参考答案:C
本题解析:分析:pH=1溶液中,含大量的H+,根据离子之间不能结合生成水、气体、沉淀等,不能发生氧化还原反应,则能大量共存,以此来解答.
解答:A.酸溶液中MnO4-、Cl-发生氧化还原反应,不能共存,故A错误;
B.Fe2+、H+、NO3-发生氧化还原反应,不能共存,故B错误;
C.酸性溶液中该组离子之间不反应,能大量共存,故C正确;
D.H+、HCO3-发生反应生成水和二氧化碳,不能共存,故D错误;
故选C.
点评:本题考查离子的共存,为高考常考习题,注重学生思维全面性、严密性的考查,侧重氧化还原反应的分析,题目难度中等.
本题难度:困难
2、选择题 把过氧化钠投入含有HCO3?-、Cl-、Mg2+、Na+的水溶液中,离子数目不变的是
A.HCO3?-
B.Cl-
C.Mg2+
D.Na+
参考答案:B
本题解析:试题分析:过氧化钠与水反应生成了氢氧化钠,所以过氧化钠投入含有HCO3?-、Cl-、Mg2+、Na+的水溶液,得高的是强碱性的溶液,而HCO3?-、Mg2+不能在强碱性溶液中存在,所以其离子的数目减少,发生了变化,过氧化钠与水反应生成了氢氧化钠,使得钠离子的数目变多,而Cl-的数目不变故本题的答案选择B。
考点:离子共存
点评:本题考查了离子共存的知识,该知识高考考查的重点和难度,本题要注意的是题干中的要求--离子数目不变的是,若离子减少或者是增多都不可以选。
本题难度:简单
3、选择题 在下列溶液中,各组离子一定能够大量共存的是
A.pH=2 的溶液:Fe 3+、Cu2+、 SO42-、NO3-
B.c(H+)=1×10-12mol·L-1的溶液:NH4+、K+、Cl-、AlO2-
C.水电离的c(H+)=1×10-12mol·L-1的溶液:Na+、Al3+、Br-、ClO-
D.与铝反应放出氢气的溶液:Na+ .Mg2+、Br-、Cl-
参考答案:A
本题解析:B:. c(H+)=1×10-12mol·L-1的溶液,可知溶液呈碱性,NH4+不能存在;C:水电离的c(H+)=1×10-12mol·L-1的溶液,可能是碱性或酸性溶液,Al3+与ClO-不一定能存在;D:与铝反应放出氢气的溶液,可能是碱性或酸性溶液,.Mg2+在碱性溶液中不能大量存在。
本题难度:一般
4、选择题 下列离子方程式正确的是
A.为了提取镁,在海水中加入熟石灰:MgSO4+2OH-=SO42-+Mg(OH)2
B.水杨酸()与足量的Na2CO3溶液混合:
C.在银氨溶液中滴加过量氢溴酸:[Ag(NH3)2]++OH-+3H++Br-=AgBr↓+2NH4++H2O
D.当钢铁处于酸性很弱或中性环境中发生吸氧腐蚀,正极反应:4H++O2+4e-=2H2O
参考答案:C
本题解析:分析:A.硫酸镁能完全电离;
B.酚-OH也能与碳酸钠反应;
C.反应生成AgBr;
D.钢铁处于酸性很弱或中性环境中发生析氢腐蚀.
解答:A.提取镁,在海水中加入熟石灰的离子反应为:Mg2++SO42-+Ca(OH)2=CaSO4↓+Mg(OH)2↓,故A错误;
B.水杨酸(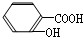 )与足量的Na2CO3溶液混合,-COOH与酚-OH均与碳酸钠反应,故B错误;
)与足量的Na2CO3溶液混合,-COOH与酚-OH均与碳酸钠反应,故B错误;
C.在银氨溶液中滴加过量氢溴酸的离子反应为[Ag(NH3)2]++OH-+3H++Br-=AgBr↓+2NH4++H2O,故C正确;
D.当钢铁处于酸性很弱或中性环境中发生析氢腐蚀,正极反应:2H++2e-=H2,↑,故D错误;
故选C.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意选项B为解答的易错点,题目难度中等.
本题难度:一般
5、选择题 向含有Fe3+、Fe2+、Mg2+、NH4+的水溶液中,加入足量的Na2O2固体,充分反应后再加入过量的稀盐酸,上述离子数目没有明显变化的是( )
A.Fe2+
B.NH4+
C.Fe3+
D.Mg2+
参考答案:A、加入Na2O2固体,会把?Fe2+被氧化成Fe3,故A错误;
B、足量过氧化钠溶于水,产生大量氢氧根离子,NH4+与氢氧根生成氨水,氨水分解产生氨气,导致铵离子减少,故B错误;
C、由于Fe2+被氧化成了Fe3,使得Fe3+增加了,故C错误;
D、在整个的反应过程中,Mg2+?数目没有变化,故D正确.
故选D.
本题解析:
本题难度:一般