| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《水的电离平衡》在线测试(2017年最新版)(四)
参考答案:B 本题解析:A、Al3+、HCO3-发生双水解,不能共存,错误;B、pH=11溶液显碱性,OH-跟四种离子大量共存,正确;C、pH=1溶液显酸性,NO3-在酸性条件下,具有强氧化性,能把Fe2+氧化成Fe3+,离子不能大量共存,错误;D、水电离的c(H+)=10-12mol·L-1,抑制了水的电离,溶液可能是酸性或碱性,Fe3+在碱性溶液不能大量共存,错误。 本题难度:一般 2、填空题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
请回答下列问题: (1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HB是强酸还是弱酸________。 (2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2 mol/L________?(填“是”或“否”)。混合溶液中离子浓度c(B-)与c(K+)的大小关系是________。 A.前者大 B.后者大 C.二者相等 D.无法判断 (3)从丙组实验结果分析,HB是________酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________。 (4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol/L。写出该混合溶液中下列算式的精确结果(不能做近似计算),c(K+)-c(B-)=_mol/L。 参考答案:(1)若a=7,则HB为强酸,若a>7,则为弱酸 本题解析:(1)因为是一元酸和一元碱等物质的量浓度等体积混合,说明恰好完全反应,生成的产物是KB,对KB溶液分析,若a=7,说明HB是强酸,若a>7,说明溶液因B-的水解而显碱性,则HB是弱酸。(2)c1不一定等于0.2。当HB是强酸时等于0.2;当HB是弱酸时,大于0.2。因为pH=7,说明c(H+)=c(OH-),那么根据电荷守恒可知,一定有c(K+)=c(B-)。(3)由丙组实验数据可知,两溶液等体积等物质的量浓度混合后pH>7。说明B-水解,得到HB是弱酸,其他易推知。(4)丁组实验中所得溶液的pH=9,说明溶液中c(H+)=10-9mol/L,则由水电离产生的c(H+)=c(OH-)= 本题难度:困难 3、选择题 90 ℃时水的离子积KW=3.8×10-13,该温度时纯水的pH是 |
参考答案:B
本题解析:该温度下氢离子浓度是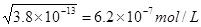 ,所以pH小于7,答案选B。
,所以pH小于7,答案选B。
本题难度:简单
4、计算题 某温度下,纯水电离出的c(H+)=2×10—7mol/L。
(1)该温度下,0.1mol/L 盐酸的PH= ,0.1mol/L NaOH溶液中的c(H+)=
(2)该温度下,pH=13的NaOH溶液中的c(OH—)是pH=11的NaOH溶液中的c (OH—)的 倍,若将两者以等体积混合,所得溶液pH值为 。(lg2=0.3,lg3=0.5,lg5=0.7)
(3)该温度下,等物质的量浓度的NaOH溶液与盐酸按3∶2体积比混合(不考虑混合时的体积变化),所得溶液的pH值为12,它们的浓度为 。
参考答案:(1)1 ,4×10-13mol/L (2) 100 , 12.7 。(3)0.2 mol/L。
本题解析:(1) pH = —lg c(H+)=1;由纯水电离出的c(H+)=2×10—7mol/L知道, Kw=4×10-14 (mol/L)2,c(H+)=10-14/ c(OH—)= 4×10-13mol/L;
(2)pH=13的NaOH溶液中的c(OH—)= 4×10-14/10-13="0.4;" pH=11的NaOH溶液中的c (OH—) =4×10-14/10-11="0.004;" 若将两者以等体积混合,则有c (OH—)=(0.4×V+0.004×V)/2V≈0.2,
C(H+)= 4×10-14 /0.2="2" ×0-13, pH = —lg c(H+ )=13—lg2="12.7;"
(3)设浓度为C,则有(3VC-2VC)/5V=0.04,C="0.2" mol/L.
考点:溶液中离子浓度和pH简单计算
本题难度:一般
5、选择题 常温下,把pH=3的H2SO4溶液和pH=10的NaOH溶液混合,两者恰好中和,则酸和碱的体积比应是
A.10∶1
B.1∶10
C.1∶100
D.1∶2
参考答案:B
本题解析:pH=3H2SO4溶液中c(H+)=10-3mol/L,pH=10的NaOH溶液中c(OH-)=10?14÷10?10mol/L=10-4mol/L,两溶液恰好中和,则n(H+)=n(OH-),所以Vac(H+)=Vbc(OH-),所以Va:Vb=c(OH-):c(H+)=10-4mol/L:10-3mol/L=1:10,故B项正确。
考点:本题考查pH的计算。
本题难度:一般
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学知识点总结《化学实验的.. | ||