微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 下方图中A~K均为中学化学中常见的物质,其中A和F是金属单质,D是最常见的溶剂。I为黄绿色气体,C的焰色反应呈黄色,K是红褐色固体。
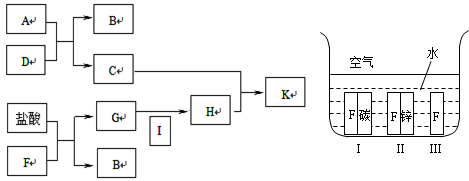
(1)A元素在周期表中位于第?周期?族?。
(2)G+I→H的离子方程式为?。
(4)如上方右图所示,F处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,该金属被腐蚀的速率由快到慢的顺序是(填序号)_______________。
参考答案:(6分)
(1)第? 3?周期? ⅠA?族。
(2)离子方程式为? 2Fe2++Cl2=2Fe3++2Cl-?。
(4)由快到慢的顺序是(填序号) Ⅰ>Ⅲ>Ⅱ 。
本题解析:C的焰色反应呈黄色,应含有Na元素,则A应为Na,D是最常见的溶剂,应为H2O,A和D反应生成NaOH和H2,则C为NaOH,B为H2,I为黄绿色气体,应为Cl2,K是红褐色固体,应为Fe(OH)3,则H为FeCl3,G为FeCl2,F为Fe,
(1)由以上分析可知A为Na,原子 核外有3个电子层,最外层电子数为1,应位于周期表第三周期、ⅠA族,
故答案为:三;ⅠA;
(2)D为H2O,I为Cl2,二者反应生成HCl和HClO,反应的离子方程式为Cl2+H2O=H++Cl-+HClO,G为FeCl2,具有还原性,可被Cl2氧化生成FeCl3,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:Cl2+H2O=H++Cl-+HClO; 2Fe2++Cl2=2Fe3++2Cl-;
(3)G为FeCl2,含有Fe2+,加入KSCN溶液不变色,但Fe2+具有还原性,可被H2O2氧化为Fe3+,溶液变红,
故答案为:H2O2、KSCN;
(4)金属腐蚀时,原电池腐蚀比化学腐蚀快,当铁为原电池负极时,易被氧化而腐蚀,当为原电池正极时,得到保护,则该金属被腐蚀的速率由快到慢的顺序是Ⅰ>Ⅲ>Ⅱ,故答案为:Ⅰ>Ⅲ>Ⅱ。
点评:本题考查元素化合物的推断,难度不大,可根据物质的特殊颜色或特殊化学反应推断元素或化合物,注意“题眼”的确定,准确确定“题眼”是解推断题的关键,学习中注意把握金属腐蚀快慢的比较。
本题难度:困难
2、填空题 原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2离子化合物。
(1)写出Y2O2的电子式?;其中含有的化学键是??
(2)X、Z、W三种元素的最高氧化物对应的水化物酸性最强的是(填写化学式):
?;
(3)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是(填写化学式);
?;
(4)与Z上下相邻的同主族元素M、N,原子电子层数M>Z>N,三种元素氢化物沸点由大到小的顺序是(填写化学式)?>?>?
(5)元素Y的单质在一定条件下,能与氢气化合生成一种固态氢化物YH,熔点为800℃。
①YH晶体类型是??
②YH能与水反应放氢气,写出化学方程式??
③若将1molYH和1molAl混合加入足量水中,放出气体的体积是(标准状况下)?L。
参考答案:
(1)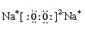 ;离子键、非极性键(每空1分,共2分)
;离子键、非极性键(每空1分,共2分)
(2)HClO4(1分)
(3)NH3(1分)
(4)H2O>H2Se>H2S(2分)
(5)①离子晶体(2分)
②NaH+H2O=NaOH+H2↑(2分)
③56(2分)
本题解析:
本题综合考查元素周期律与化学键,元素化合物性质知识,考查内容有一定的层次性;解题的关键是根据氢化物确定元素在周期表中的族序数,由XH3、H2Z和HW三种共价化合物,可知,X在第VA族,Z在第VIA族,W在第VIIA族,Y可与氧气形成Y2O和Y2O2离子化合物,可推测Y为Na元素;由四种短周期元素原子序数依次增大,可确定X为N,Y为Na,Z为S,W为Cl;(1)Y2O2的电子式为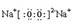 ;其中含有非极性共价键和离子键;(2)X、Z、W三种元素的最高氧化物对应的水化物酸性最强的是HClO4;(3)NH3是碱性气体,可与H2S,HCl反应;(4)根据题意,与Z上下相邻的同主族元素M为Se,N为O,三种元素氢化物分别为H2O 、H2Se、H2S,由于受氢键的影响,H2O的沸点高于H2S,所以三者的沸点由大到小为H2O>H2Se>H2S;(5)钠与氢形成的化合物为NaH,属于离子晶体;与水反应的方程式为NaH+H2O=NaOH+H2↑;由反应可知,1molNaH与水反应放出氢气22.4L,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,1molAl与水反应放出氢气33.6L,共产生气体56L。
;其中含有非极性共价键和离子键;(2)X、Z、W三种元素的最高氧化物对应的水化物酸性最强的是HClO4;(3)NH3是碱性气体,可与H2S,HCl反应;(4)根据题意,与Z上下相邻的同主族元素M为Se,N为O,三种元素氢化物分别为H2O 、H2Se、H2S,由于受氢键的影响,H2O的沸点高于H2S,所以三者的沸点由大到小为H2O>H2Se>H2S;(5)钠与氢形成的化合物为NaH,属于离子晶体;与水反应的方程式为NaH+H2O=NaOH+H2↑;由反应可知,1molNaH与水反应放出氢气22.4L,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,1molAl与水反应放出氢气33.6L,共产生气体56L。
本题难度:一般
3、简答题 A、B、C、D均为中学化学常见物质,它们之间的反应关系如图所示.
(1)若A是碳化钙,A与B的水溶液反应时只生成气体C、CaCO3和H2O.则B(只含两种元素)的化学式为______,其固态时的晶体为______晶体;C分子中含有的化学键类型是______.
(2)若A是短周期中原子半径最大的元素的单质,D既可溶于NaOH溶液又可溶于盐酸.请写出:
①D溶于盐酸的离子方程式______.
②工业上冶炼A的化学方程式______.
③实验室用惰性电极电解100mL?0.1mol/L?A的氯化物的水溶液(滴有酚酞),一段时间后,若阴阳两极均得到112mL气体(标准状况),则所得溶液的pH为______(忽略反应前后溶液的体积变化).某电极附近溶液颜色变红,原因是______,则该电极与外接直流电源的______极相连接(填“正”、或“负”).
(3)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则反应的化学方程式是______.
(4)若A常温下为红棕色气体,B是含氧酸盐,D不溶于盐酸,则D的化学式是______.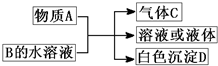
参考答案:(1)碳化钙遇水会剧烈反应生成氢氧化钙和乙炔气体,生成的氢氧化钙再与B发生反应,能生成碳酸钙沉淀,B只含两种元素,只能为CO2,固态CO2为分子晶体,C为CH≡CH,含有极性键和非极性键,
故答案为:CO2;分子;极性键和非极性键;
(2)若A是短周期中原子半径最大的元素的单质,应为Na,工业用电解NaCl的方法冶炼,D既可溶于NaOH溶液又可溶于盐酸,应为Al(OH)3,
①Al(OH)3与盐酸反应生成Al3+,反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
②工业用电解熔融的NaCl的方法冶炼Na,方程式为2NaCl?电解?.??2Na+Cl2↑,故答案为:2NaCl?电解?.??2Na+Cl2↑;
③电解NaCl溶液两极反应为:阳极:2Cl--2e-=Cl2↑;阴极:2H++2e-=H2↑,两极均得到112mL气体,即0.112L22.4L/mol=0.005mol,Cl-刚好反应完,生成2×0.005mol=0.01molOH-,则所得溶液的pH为13,阴极与电源的负极相连接,氢离子在阴极得到电子生成氢气,水的电离平衡被破坏,使得阴极附近氢氧根离子浓度大于氢离子浓度,电极附近溶液颜色变红,
故答案为:13;氢离子在阴极得到电子生成氢气,水的电离平衡被破坏,使得阴极附近氢氧根离子浓度大于氢离子浓度;负;
(3)A能与强碱反应放气体,则A为铵盐,从D不用于稀硝酸可推知D为硫酸钡,进而推知B为硫酸铵,反应的方程式为Ba(OH)2+(NH4)2SO4=BaSO4↓+2NH3↑+2H2O,
故答案为:Ba(OH)2+(NH4)2SO4=BaSO4↓+2NH3↑+2H2O;
(4)A常温下为红棕色气体,应为NO2,与水反应生成NO和硝酸,B是含氧酸盐,与硝酸反应生成含氧酸,D不溶于盐酸,应为H2SiO3,
故答案为:H2SiO3.
本题解析:
本题难度:一般
4、推断题 已知X、Y、Z为单质,其他为化合物。其中Y为气体,G溶液呈黄色,E是不溶于水的酸性氧化物,能与氢氟酸反应,它们之间存在如下转化关系(部分产物已略去)。请回答下列问题
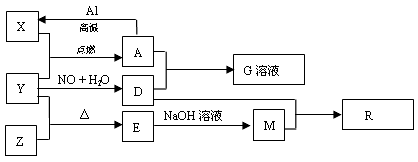
(1)E的化学式是________。
(2)M的水溶液俗称___________,它与D反应的化学方程式为________________。
(3)写出A和D的稀溶液反应生成G的离子方程式________________。
(4)向含2mol D的稀溶液中,逐渐加入X粉末至过量。假设生成的气体只有一种,则n(Xm+)的最大值为
________。
参考答案:(1)SiO2
(2)水玻璃;Na2SiO3+2HNO3= H2SiO3↓+ 2NaNO3
(3)3Fe3O4+28H++NO3-= 9Fe3++NO↑+14H2O
(4)0.75mol
本题解析:
本题难度:一般
5、填空题 (10分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属, K是一种红棕色气体。


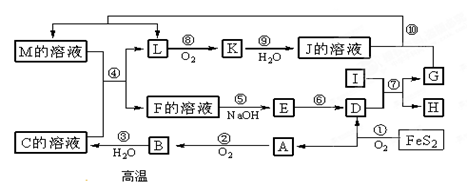
请填写下列空白:
⑴ 在周期表中,组成单质G的元素位于第____________周期_________族。
⑵ 在反应⑦中氧化剂与还原剂的物质的量之比为___________________。
⑶ 在②、③、⑥、⑨中既属于化合反应又属于非氧化还原反应的是___________(填序号)
⑷ 反应④的离子方程式是:__________________________________。
⑸ 将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:_________________________。
参考答案:(1)四(或4);Ⅷ(2分)?(2)1:2(2分)?(3)③(2分)?
(4)3Fe2++NO3-+4H+ = 3Fe3++NO↑+2H2O(2分)?
(5)Fe2O3+3KNO3+4KOH =2K2FeO4+3KNO2+2H2O(2分)
本题解析:I是由第三周期元素组成的单质中熔点最高的金属,则I一定是铝。K是一种红棕色气体,所以K是NO2。因此L是NO。NO2溶于水又生成硝酸和NO,所以J是硝酸。FeS2燃烧生成氧化铁和SO2,所以A是SO2,则D是氧化铁,氧化铁和铝发生铝热反应生成氧化铝互溶单质铁。根据反应⑩可知,反应是氧化还原反应,所以G是铁,H是氧化铝。SO2氧化生成三氧化硫,则B是三氧化硫,三氧化硫溶于水生成硫酸,因此C是硫酸。根据反应④可知,该反应是氧化还原反应,所以M应该是硝酸亚铁,则F是铁盐,所以E是氢氧化铁,氢氧化铁分解生成氧化铁。
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般