微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 A、B、C、D、E五种化合物,均含有某种短周期常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。

(1)写出化学式:A________,B________,C________,D________,E________。
(2)写出下列反应的离子方程式:
A→B___________________, A→D_______________________
参考答案:(1)KAlO2;Al(OH)3;Al2O3;AlCl3;NaAlO2
(2)AlO2-+CO2+2H2O===Al(OH)3↓+HCO3-;AlO2-+4H+===Al3++2H2O
本题解析:
本题难度:一般
2、填空题 (10分,每空2分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
还原法在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:

有关离子完全沉淀的pH如下表:
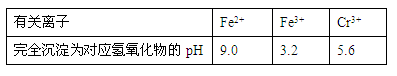
(1)写出Cr2O72—与FeSO4溶液在酸性条件下反应的离子方程式________________________________________________________。
(2)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
则在操作②中可用于调节溶液pH的试剂为:_____________(填序号);
A.Na2O2? B.Ca(OH)2? C.Ba(OH)2? D.NaOH
此时调节溶液的pH范围在____________(填序号)最佳。
A.12~14? B.10~11? C.6~8? D.3~4
(3)将等体积的4.0×10-3mol·L-1的AgNO3和4.0×10-3mol·L-1的K2CrO4溶液混合能析出Ag2CrO4沉淀(Ksp(Ag2CrO4)=9.0×10-12),请写出表示Ag2CrO4溶解平衡的方程式(2分),并简要写出能生成Ag2CrO4沉淀原因的计算过程(2分)。
参考答案:(每空2分,总计10分)
(1)Cr2O72— + 6Fe2+ +14H+ ="=" 2Cr3+ + 6Fe3+ + 7H2O。
(2)B?C
(3)Ag2CrO4 (s)  ?2Ag+(aq) + CrO42—(aq)
?2Ag+(aq) + CrO42—(aq)

本题解析::(1)二价铁离子有还原性,Cr2O72-有强氧化性,二者能发生氧化还原反应,二价铁离子被氧化成三价铁离子,Cr2O72-被还原为Cr3+,反应方程式为Cr2O72-+6Fe2++14H+═2 Cr3++6Fe3++7H2O。
故答案为:Cr2O72-+6Fe2++14H+═2 Cr3++6Fe3++7H2O。
(2)A.Na2O2有强氧化性,能把Cr3+氧化成Cr6+,从而得不到Cr(OH)3,故错误。
B.Ca(OH)2和 D.NaOH使Fe3+和Cr3+产生氢氧化物沉淀,且没有其它沉淀杂质生成,故正确。
C.Ba(OH)2和硫酸根离子能产生硫酸钡沉淀,生成杂质,故错误。
在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀,且没有氢氧化亚铁沉淀,所以溶液的PH应大于5.6小于9,所以B正确。
故答案为:B;C。
点评:本题考查了离子方程式的书写,难度不大,注意题中的图示和表中所提供的信息,分析透彻题中所给出的信息解题的关键。
本题难度:简单
3、选择题 X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图转化关系(其它产物已略),下列说法不正确的是( )
A.若W是单质铁,则Z溶液可能是FeCl2溶液
B.若W是氢氧化钠,则X与Z可能反应生成Y
C.若X是金属镁,则W可能是强氧化性的单质
D.若X为甲醇,则X、Z的相对分子质量可能相差14
