微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 过二硫酸钾(K2S2O8)是一种无色结晶,不溶于乙醇,有强氧化性,易分解。实验室制备过二硫酸钾可通过低温电解KHSO4认溶液得到。
实验步骤如下:
步骤1.称取40gKHSO4溶解90mL蒸馏水,倒入大试管,试管浸在冰水浴中(装置见图9),并冷却到5℃以下。
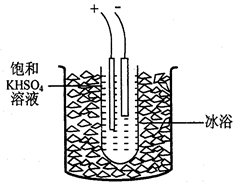
步骤2电解2h,每隔约半小时补一次冰
步骤3.将沉淀收集在漏斗中,直接用乙醇和乙醚洗涤和过滤
步骤4.干燥、称重
步骤5.回收乙醚和乙醇
(1)电解总反应的化学方程式为?。
(2)电解过程中,阳极产生微量且能使湿润的KI-淀粉变蓝的有色单质气体,该气体可能是(填化学式)。
(3)步骤2每隔半小时要向大烧杯添加冰块,其原因是?。
(4)步骤5回收乙醇、乙醚时采用的操作方法是?。
(5)取得到的样品0.2500g溶于30mL水,加4gKI,塞住瓶塞,振荡,静止15min,加入1mL冰醋酸,再用cmol·L- 1Na2S2O3溶液滴定。(S2O82- +3I- =2SO42- +I3-;I3- I2+I-;2S2O32-+I2=2I- + S4O62-)
I2+I-;2S2O32-+I2=2I- + S4O62-)
①溶解时,加入KI后需塞住瓶塞,其目的是?。
②本实验所用的指示剂为?。
③若本次滴定消耗Na2SO3溶液VmL,由本次结果计算,样品中K2S2O8的纯度为(用含c、V的代数式表示)。
(6)分析化学上检验Mn2+在Ag+催化下K2S2O8溶液将Mn2+氧化为紫色的MnO4-,该反应的离子方程式为 。
2、实验题 某研究小组探究SO2和Fe(NO3)3溶液的反应。
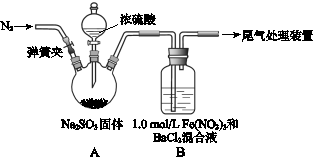
已知: 1.0 mol·L-1的Fe(NO3)3溶液的pH=1,请回答:
(1)装置A中反应的化学方程式是?。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是?。
(3)装置B中产生了白色沉淀,其成分是?,说明SO2具有?性。
(4)分析B中产生白色沉淀的原因:
观点1:?_____________________________;
观点2:SO2与Fe3+反应;
观点3:在酸性条件下SO2与NO3-反应;
①若观点2正确,装置B中反应的离子方程式是?。
②只需将装置B中的 Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,即可证明观点3是否正确,应选择的试剂是(填序号)?。
a.0.1 mol·L-1稀硝酸?
b.1.5 mol·L-1 Fe(NO3)2溶液
c.6.0 mol·L-1 NaNO3和0.2 mol/L盐酸等体积混合的溶液
3、填空题 (1)用18mol·L-1的硫酸配制1.00 mol· 的硫酸100mL。若实验仪器有:
的硫酸100mL。若实验仪器有:
A.100mL量筒、B.托盘天平、C.玻璃棒、D.50mL容器瓶、E. 10mL量筒、
F.胶头滴管、G. 50mL烧杯、H. 100mL容量瓶。
实验时应选用仪器是?(填 字母);
字母);
(2)在容量瓶的使用方法 中,下列操作不正确的是?(填字母);
中,下列操作不正确的是?(填字母);
A.使 用容量瓶前检查其是否漏水。
用容量瓶前检查其是否漏水。
B.容量瓶用蒸馏水洗净后,再用待配溶液洗涤。
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1—2cm处,用胶头滴管滴加蒸馏水到刻度线。
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1—2cm处,用胶头滴管滴加蒸馏水到刻度线。
E.盖好瓶盖,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
(3)浓H2SO4稀释时应该?
?;
(4)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响?(填“偏高”、“偏低”或“不变”)
①稀释硫酸后的烧杯未洗涤:?;
②未经冷却趁热将溶液注入容量瓶中:?;
③摇匀后发现液面低于刻度线再加水:?;
④容量瓶中原有少量蒸馏水:?。
4、实验题 (15分)利用有机反应R-H+Cl2 R-Cl(液)+HCl(气)制取副产品盐酸的设想己成为现实。请根据所给模拟装置图回答下列问题:
R-Cl(液)+HCl(气)制取副产品盐酸的设想己成为现实。请根据所给模拟装置图回答下列问题:
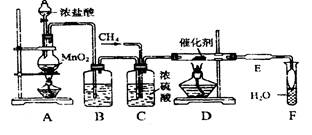
(1)装置B中盛放的溶液是?
其作用是?。
(2)写出C装置的三种功能:
①?;
②?;
③?;
(3)玻璃管D中所放石棉碎块的作用是??
玻璃管E中所放碘化钾的作用是?
(4)F中导管末端做成“膨大”形的作用是?
(5)①点燃A处酒精灯,②点燃D处酒精灯,③通入CH4,这三种操作的先后顺序是
__________? ___(依次填代号)
5、选择题 下列实验能成功的是 ?( ? )
A.将乙酸和乙醇混合加热制乙酸乙酯
B.用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热
C.CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型
D.苯和浓溴水反应制溴苯