微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,0.1mol/LCH3COONa溶液中离子浓度最大的是( )
A.OH-
B.H+
C.Na+
D.CH3COO-
参考答案:醋酸钠是强碱弱酸盐,钠离子不水解,醋酸根离子水解而导致其溶液呈碱性,但醋酸根离子水解程度较小,溶液中离子以盐电离为主,所以溶液中离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),
故选C.
本题解析:
本题难度:一般
2、选择题 将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是
[? ]
A.c(Ac-)>c(Cl-)>c(H+)>c(HAc)
B.c(Ac-)>c(Cl-)>c(HAc) >c(H+)
C.c(Ac-)=c(Cl-)>c(H+)>c(HAc)
D.c(Na+)+c(H+)=c(Ac-)>c(Cl-)+c(OH-)
参考答案:BD
本题解析:
本题难度:一般
3、选择题 下列混合溶液中,各离子浓度的大小顺序正确的是
[? ]
A.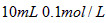 氨水与
氨水与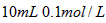 盐酸混合,
盐酸混合,
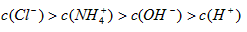
B. 溶液与
溶液与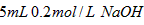 溶液混合,
溶液混合,
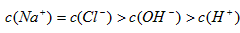
C.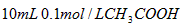 溶液与
溶液与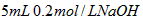 溶液混合,
溶液混合,

D.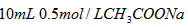 溶液与
溶液与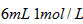 盐酸混合,
盐酸混合,
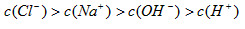
参考答案:B
本题解析:
本题难度:一般
4、选择题 常温下,0.1 mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是
[? ]
A.该溶液中水电离出的c(H+)=1×10-10 mol·L-1
B.该溶液中c(H+)+c(A-)+c(HA)=0.1 mol·L-1
C.该溶液与0.05 mol·L-1 NaOH溶液等体积混合后:c(A-)>c(Na+)>c(OH-)>c(H+)
D.向该溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大
参考答案:D
本题解析:
本题难度:一般
5、简答题 (1)向20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,请回答相关问题:
①当加入10.00mL盐酸时,溶液中各种离子浓度之间的大小关系为(请在括号中填入离子符号):c______>c______>c______>c______
②当盐酸与氨水等物质的量反应时,溶液的pH______7(填“>”或“<”或“=”,下同)
③当溶液pH=7时,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为:n(NH3?H2O)______n(HCl),溶液中c(?NH4+)______c(Cl-).
(2)已知某弱酸的酸式酸根离子HB-既能发生电离,又能发生水解,请通过实验确定HB-离子是电离程度大还是水解程度大?请简述实验过程和结论.____________.
参考答案:(1)①当加入10.00mL盐酸后,溶液为等物质的量浓度的氨水与氯化铵的混合液,氨水电离使呈碱性,氯化铵水解使溶液呈酸性,等物质的量浓度,电离程度大于水解程度,溶液呈碱性,即:c(?OH-)>c(H+);
?根据电荷守恒有:(NH4+)+c(H+)=c(Cl-)+(?OH-),溶液呈碱性,所以,c(NH4+)>c(Cl-);
水解程度微弱,溶液中c(Cl-)远远大于c(?OH-),
故溶液中各种离子浓度之间的大小关系为c(NH4+)>c(Cl-)>c(?OH-)>c(H+).
故答案为:c(NH4+)>c(Cl-)>c(?OH-)>c(H+)?
②盐酸与氨水恰好反应,为氯化铵溶液,氯化铵是强酸弱碱盐,故溶液呈酸性,即PH<7
故答案为:<
③根据电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(?OH-),由于溶液pH=7,即c(?OH-)=c(H+),所以c(NH4+)>c(Cl-),溶液中存在平衡?NH4++H2O?NH3?H2O,根据物料守恒有,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为:n(NH3?H2O)>n(HCl).
故答案为:>;=
(2)用pH试纸测NaHB溶液的pH值,若pH>7,说明HB-水解程度大于其电离程度;若pH=7,说明其水解程度等于其电离程度;如果pH<7,则说明其水解程度小于其电离程度.
故答案为:用pH试纸测NaHB溶液的pH,若pH>7,说明HB-水解程度大于其电离程度;若pH=7,说明其水解程度等于其电离程度;如果pH<7,则说明其水解程度小于其电离程度.
本题解析:
本题难度:一般