参考答案:(1)由表中数据可知,30.0ml同浓度的盐酸加入255mg金属,盐酸有剩余,金属完全反应.加入385mg金属与加入510mg金属生成的氢气体积一样多,故加入385mg金属,盐酸完全反应,此时生成氢气336mL,氢气的物质的量为0.336L22.4L/mol=0.015mol,根据氢元素守恒可知n(HCl)=2n(H2)=2×0.015mol=0.03mol,故盐酸的物质的量浓度为0.03mol0.03L=1mol/L.
故答案为:1mol/L;乙、丙.
(2)由表中甲、乙数据可知,甲中盐酸有剩余,金属完全反应,此时生成氢气280mL,故可以根据甲组数据计算金属的物质的量之比.
令镁、铝的物质的量分别为xmol、ymol,根据二者质量可知24x+27y=0.255,根据电子转移守恒有2x+3y=0.28L22.4L/mol×2,联立方程解得:x=0.005、y=0.005,故合金中镁与铝的物质的量之比为0.005mol:0.005mol=1:1.
故答案为:甲;1:1.
(3)甲中盐酸有剩余,255mg金属完全反应,此时生成氢气280mL,故生成336mL氢气需要金属的质量为255mg×336mL280mL=306mg,故金属有剩余.
故选:A.
(4)丙实验之后,向容器中加入一定量的1.00mol/l的NaOH溶液能使合金中的铝粉恰好完全溶解,溶液中溶质为氯化钠、偏铝酸钠.
由(2)中计算Mg、Al的物质的量可知丙中Al的物质的量为0.005mol×510mg255mg=0.01mo,根据铝元素守恒计算偏铝酸钠的物质的量为0.01mol,根据氯离子守恒可知n(NaCl)=1mol/L×0.03L=0.03mol,根据钠离子守恒可知n(NaOH)=n(NaCl)+n(NaAlO2)=0.03mol+0.01mol=0.04mol,故需要氢氧化钠溶液的体积为0.04mol1mol/L=0.04L=40mL.
故答案为:滤液中的溶质NaClNaAlO2对应物质的量/mol0.030.01加入NaOH溶液的体积/ml40
本题解析:
本题难度:一般
2、简答题 铝镁合金现已成为轮船制造、化工生产等行业的重要原料.现有一块铝镁合金,欲测定其中镁的质量分数,几位同学分别称取3.9克样品,并设计了不同的实验方案:
甲:铝镁合金 测得生成气体的体积Vml(已折算成标准状况);
乙:铝镁合金→测得剩余固体的质量a克;
丙:铝镁合金?溶液??测得沉淀的质量2.9克.
(1)写出实验设计甲有关反应的离子方程式:______;该方案能否测定出镁的质量分数?______(填“能”或“不能”)
(2)实验设计乙所加入的试剂是______,测得的镁的质量分数为______
(3)实验设计丙中加过量的NaOH溶液充分反应后,______(填一种分离方法),洗涤烘干沉淀,测得镁的质量分数为(保留小数点后一位小数)______,如果未洗涤沉淀,测得镁的质量分数将______(填“偏大”、“偏小”或“无影响”).
参考答案:(1)铝与盐酸反应生成氯化铝与氢气,反应离子方程式为2Al+6H+═2Al3++3H2↑,镁与盐酸反应生成氯化镁与氢气,反应离子方程式为Mg+2H+═Mg2++H2↑;
令合金中Mg、Al的物质的量分别为xmol、ymol,用x、y表示出各自生成的氢气,利用二者质量之和为3.9g,列方程可以计算出x、y的值,可以测量测定出镁的质量分数,
故答案为:2Al+6H+═2Al3++3H2↑、Mg+2H+═Mg2++H2↑;能;
(2)铝与氢氧化钠反应溶解,镁不能与氢氧化钠反应,故可以加入氢氧化钠溶液,剩余的固体为Mg,故得合金中Mg的质量分数为ag3.9g×100%=100a3.9%,
故答案为:NaOH溶液;100a3.9%;
(3)由转化关系可知,最后的沉淀是氢氧化镁,分离固体与溶液常用的分离方法是过滤;
氢氧化镁的质量是2.9g,根据镁元素守恒可知合金中Mg的质量为2.9g×2458=1.2g,所以合金中Mg的质量分数为1.2g3.9g×100%=30.8%;
未洗涤沉淀,氢氧化镁沉淀附着其它物质,使测定的氢氧化镁的质量增大,导致测定合金中Mg的质量增大,测定的合金中镁的质量分数偏大,
故答案为:过滤;30.8%;偏大.
本题解析:
本题难度:一般
3、实验题 (15分)有甲、乙两个探究性学习小组,他们拟用小颗粒状铝硅合金与足量稀硫酸的反应测定通常状况(约20℃,1atm)下气体摩尔体积的方法。
(1)甲组同学拟选用图27题-l的实验装置完成实验:
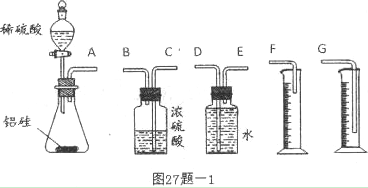
①铝硅合金与足量稀硫酸的反应的离子方程式__________________________________。
②该组同学必须选用的装置的连接顺序是A接(? )(? )接(? )(? )接(? )(填接口字母,可不填满。)
③实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,过一会儿后稀硫酸就不能顺利滴入锥形瓶。请你帮助分析原因_________________________________________
_____________ _______________________________________________________________。 _______________________________________________________________。
④实验结束时,测量实验中生成氢气的体积时应注意:a.待实验装置
冷却到(约20℃,1atm)后,上下移动量筒,使其中液面与广口瓶中
液面相平,b.______________________________________。
(2)乙组同学仔细分析甲组同学的实验装置后,认为来源:91考试网 91ExaM.org:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了图27题-2所示的实验装置。
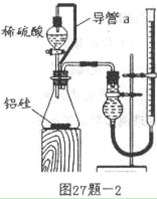
装置中导管a的作用是
_________________________ ___________________________ ___________________________
_____________________________________________________。
②实验中准确测得4个数据:实验前铝硅合金的质量m1g,实验后残留固体的质量m2g,实验前后碱式滴定管中液面读数分别为V1mL、V2mL。则通常状况时气体摩尔体积Vm=_______L·moL-1。
参考答案:
本题解析:略
本题难度:困难
4、填空题 将一定质量的镁铝合金样品全部溶于100mL某浓度的盐酸中。向所得溶液中滴加5.0mol/L的NaOH溶液,生成沉淀质量与加入的NaOH溶液体积关系如右图所示。求:
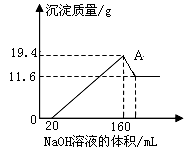
(1)A点沉淀物的化学式为 _?。
(2)原合金中的Mg 、Al质量各多少克?
(3)盐酸的物质的量浓度。
参考答案:(1)Mg(OH)2、 Al(OH)3 。
(2) Mg 4.8g、Al2.7g
(3)c(HCl)=0.8mol/0.1L=8mol·L-1
本题解析:从图中横坐标可以看出,加入20mL的氢氧化钠溶液时,没有产生沉淀,此段是盐酸与氢氧化钠发生中和反应;当氢氧化钠继续加入时,沉淀不断增加,沉淀为氢氧化镁和氢氧化铝,直到沉淀最大值;继续添加氢氧化钠,则氢氧化铝参与反应,生成偏铝酸钠。故11.6g沉淀是氢氧化镁,(19.4-11.6)g是氢氧化铝的质量。根据守恒法可知,n(Mg)=n(Mg(OH)2)= 11.6g÷58g/mol=0.2mol,故镁的质量为0.2mol×24g/mol=4.8g。同理可求出铝的质量为2.7g。当氢氧化钠加入量为160mL时,溶质均为NaCl,根据守恒法可知,n(HCl)=n(Cl-)=n(NaOH)=0.16L×5.0mol/L=0.8mol。
点评:金属及其化合物是重要的无机物,是历年高考的重点。考生在备考过程中应注意积累各物质的性质及重要的化学反应。
本题难度:一般
5、选择题 将钠、铝混合物(质量A1g)投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体7.84L.向溶液中逐滴加入浓度为2mol?L-1的H2SO4溶液,至100ml时白色沉淀达到最大量.继续滴入H2SO4溶液,当加入H2SO4溶液的体积为xml时沉淀恰好消失.将所得溶液蒸干灼烧得固体A2g.下列关系式中不正确的是( )
A.沉淀达到最大量时溶液中的溶质为Na2SO4、NaHSO4
B.x=75ml
C.A1=11.9
D.白色沉淀最大量为7.8g
参考答案:A.将钠、铝混合物投入水中,发生的反应为2Na+2H2O═2NaOH+H2↑,2Al+2NaOH+2H2O═2NaAlO2+3H2↑,向溶液中加入硫酸,当沉淀量最大时,发生的反应为2H2O+2NaAlO2+H2SO4=2 Al(OH)3↓+Na2SO4,溶液中的溶质是Na2SO4,故A错误;
B.当沉淀的量最大时,溶液中的溶质是硫酸钠,根据Na2SO4中钠离子和硫酸根离子的关系得n(Na)=2n(H2SO4)=0.4mol,根据转移电子相等得n(Al)=7.84L22.4L/mol×2-0.4mol×13=0.1mol,
根据铝原子守恒得n( Al(OH)3)=0.1mol,根据2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O知,需要硫酸的物质的量为0.15mol,则硫酸体积=0.15mol2mol/L=75mL,
故B正确;
C.通过以上分析知,n(Na)=0.4mol,n(Al)=0.1mol,所以A1=23g/mol×0.4mol+27g/mol×0.1mol=11.9g,故C正确;
D.根据原子守恒知,当沉淀最大时,n( Al(OH)3)=0.1mol,则m( Al(OH)3)=0.1mol×78g/mol=7.8g,故D正确;
故选A.
本题解析:
本题难度:简单
|