微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各物质中所含氢原子个数与3.2gO2分子数相同的物质是
A.0.2gNH3
B.6.02×1023个H2SO4分子
C.0.1molHCl分子
D.标准状况下1.12LCH4
参考答案:C
本题解析:分析:利用n= 来计算氧气的物质的量,再利用n=
来计算氧气的物质的量,再利用n= 、n=
、n= 、n=
、n= 及物质的构成来计算氢原子的物质的量,若氢原子的物质的量与氧气的物质的量相等,则个数相同.
及物质的构成来计算氢原子的物质的量,若氢原子的物质的量与氧气的物质的量相等,则个数相同.
解答:3.2gO2的物质的量为 =0.1mol,
=0.1mol,
A、氨气的物质的量为 =0.012mol,氢原子的物质的量为0.012mol×3=0.036mol,故A错误;
=0.012mol,氢原子的物质的量为0.012mol×3=0.036mol,故A错误;
B、H2SO4分子的物质的量为 =1mol,氢原子的物质的量为1mol×2=2mol,故B错误;
=1mol,氢原子的物质的量为1mol×2=2mol,故B错误;
C、0.1molHCl分子中氢原子的物质的量为0.1mol×1=0.1mol,故C正确;
D、标准状况下甲烷的物质的量为 =0.5mol,氢原子的物质的量为0.5mol×4=2mol,故D错误;
=0.5mol,氢原子的物质的量为0.5mol×4=2mol,故D错误;
故选C.
点评:本题考查学生利用n= 、n=
、n= 、n=
、n= 及物质的构成进行的简单计算,明确氢原子的个数与氧分子数相同,即选项中氢原子的物质的量与氧气的物质的量相等是解答本题的关键.
及物质的构成进行的简单计算,明确氢原子的个数与氧分子数相同,即选项中氢原子的物质的量与氧气的物质的量相等是解答本题的关键.
本题难度:困难
2、选择题 NA表示阿伏加德罗常数,下列判断正确的是
A.60?g?SiO2晶体中含有2?NA个Si-O键
B.0.17g?NH3中含有的共用电子对数为0.1?NA
C.1?mol?Cl2与足量Fe反应,转移电子数一定为2?NA
D.28?g丙烯、丁烯混合物完全燃烧需氧分子数为3?NA
参考答案:CD
本题解析:分析:A、依据n= 计算二氧化硅物质的量,结合1mol二氧化硅中含4molSi-O键;
计算二氧化硅物质的量,结合1mol二氧化硅中含4molSi-O键;
B、依据n= 计算物质的量,结合氨气结构计算共用电子对数;
计算物质的量,结合氨气结构计算共用电子对数;
C、氯气和铁反应生成氯化铁;
D、丙烯、丁烯最简式相同为CH2,只需计算28gCH2消耗氧气物质的量;
解答:A、60 g SiO2晶体物质的量为1mol,含4NA个Si-O键,故A错误;
B、0.17g NH3物质的量为0.01mol,含有的共用电子对数为0.03 NA,故B错误;
C、1 mol Cl2与足量Fe反应,氯从0价变化为-1价,转移电子数一定为2 NA,故C正确;
D、丙烯、丁烯最简式相同为CH2,只需计算28gCH2消耗氧气物质的量,n=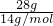 =2mol,耗氧量为2mol×1.5=3mol,28 g丙烯、丁烯混合物完全燃烧需氧分子数为3 NA,故D正确;
=2mol,耗氧量为2mol×1.5=3mol,28 g丙烯、丁烯混合物完全燃烧需氧分子数为3 NA,故D正确;
故选CD.
点评:本题考查了阿伏伽德罗常数应用,主要考查质量换算物质的量计算微粒数,氧化还原反应电子转移,注意烃的耗氧量计算,题目难度中等.
本题难度:简单
3、选择题 已知1.505×1023个某气体分子的质量为8g,则该气体的摩尔质量是
A.16g
B.32g
C.64g/mol
D.32g/mol
参考答案:D
本题解析:分析:根据公式N=nNA=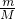 NA来计算即可.
NA来计算即可.
解答:根据公式N=nNA=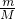 NA,则M=
NA,则M=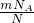 =
=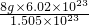 mol-1=32g/mol.
mol-1=32g/mol.
故选D.
点评:本题考查学生对教材知识的记忆,可以根据所学知识进行回答,较简单.
本题难度:简单
4、选择题 下列溶液中与100mL0.1mol/L(NH4)2SO4溶液中NH4+离子浓度相同的是
A.10mL1mol/L(NH4)2SO4溶液
B.50mL0.2mol/LNH4Cl溶液
C.10mL0.2mol/L(NH4)2SO4溶液
D.200mL0.1mol/LNH4NO3溶液
参考答案:B
本题解析:分析:根据物质的化学式及物质的物质的量浓度来计算NH4+的物质的量浓度,并注意离子的浓度取决于物质的物质的量浓度,而与体积无关系.
解答:100mL0.1mol/L(NH4)2SO4溶液中NH4+离子浓度为c(NH4+)=0.2mol/L.
A、10mL1mol/L(NH4)2SO4溶液,c(NH4+)=2c[(NH4)2SO4)]=2mol?L-1;
B、50mL0.2mol/LNH4Cl溶液,c(NH4+)=c(NH4Cl)=0.2mol?L-1;
C、10mL0.2mol/L(NH4)2SO4溶液,c(NH4+)=2c[(NH4)2SO4)]=0.4mol?L-1;
D、200mL0.1mol/LNH4NO3溶液,c(NH4+)=c(NH4NO3)=0.1mol?L-1;
故选:B.
点评:本题考查一定物质的量浓度溶液中所含微粒的物质的量浓度,所含微粒的物质的量浓度与所取溶液的体积大小无关.
本题难度:困难
5、选择题 100℃时,KCl溶液中溶质的物质的量浓度为C1.降至室温后析出m?g?KCl晶体(晶体中不含结晶水),所得溶液中溶质的物质的量浓度为C2,则下列说法不正确的是
A.一定条件下,KCl的溶解度是有限的
B.溶液中KCl的物质的量浓度C1一定大于C2
C.降温前后,溶液中KCl的物质的量未发生改变
D.降温过程中,结晶和溶解的速率可能出现相等
参考答案:C
本题解析:分析:溶液中固体的溶解和结晶为可逆过程,降至室温后析出mgKCl晶体,说明随着温度的降低,溶解度降低,由于溶液体积不变,则溶液的质量分数,物质的量浓度都减小,以此解答该题.
解答:A.不同温度下,KCl的溶解度不同,且溶剂不同,溶解度也不同,故A正确;
B.降至室温后析出mgKCl晶体,由于溶液体积不变,物质的量浓度减小,故B正确;
C.降至室温后析出mgKCl晶体,溶液中KCl的物质的量分数改变,故C错误;
D.溶液中固体的溶解和结晶为可逆过程,当达到平衡时,结晶和溶解的速率相等,故D正确.
故选C.
点评:本题考查溶液的物质的量浓度大比较、溶解度等问题,题目难度不大,注意把握饱和溶液的特点以及影响溶解平衡的因素.
本题难度:简单