微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 明矾石经处理后得到明矾[KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4、和H2SO4的工艺过程如下所示:
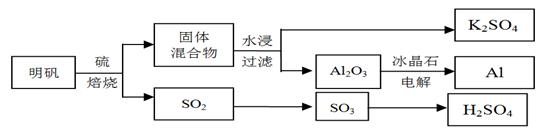
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O + 3S = 2K2SO4 + 2Al2O3 + 9SO2 + 48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是?。
(2)从水浸后的滤液中得到K2SO4晶体的方法是?。
(3)Al2O3在一定条件下可制得AlN,其晶体结构如图所示,该晶体中Al的配位数是?。

(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是?。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101kPa时:
2SO2(g)+ O2(g) 2SO3(g)?△H1 = -197 kJ /mol;
2SO3(g)?△H1 = -197 kJ /mol;
H2O(g) H2O(l)?△H2 = -44 kJ/mol;
H2O(l)?△H2 = -44 kJ/mol;
2SO2(g)+ O2(g)+ 2H2O(g)=2H2SO4(aq) △H3 = -545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是?。
焙烧948 t明矾(M =" 474" g/mol),若SO2的利用率为96%,可产生质量分数为98%的硫酸?t。
参考答案:(1)S (2分)
(2)蒸发结晶(2分)
(3)4 (2分)
(4)Al+3NiO(OH)+H2O==NaAlO2+3Ni(OH)2 (3分)
(5)SO3(g)+H2O(l)==H2SO4(aq), ΔH="-130" KJ/mol (3分)? 432t (3分)
本题解析:本题氧化还原反应、物质的分离和提纯、物质的结构等知识点融合到工艺过程中,还考查了原电池原理及热化学方程式的书写,难度适中。
本题难度:一般
2、简答题 某研究型学习小组为测定镁和铝的混合物中铝的质量分数,称取该混合物a?g,溶于200mL?5mol/L?HCl溶液中,共收集到标准状况下的氢气3.36L.
(1)a?的取值范围是______.
(2)向反应后所得溶液中逐渐加入4mol/L的NaOH溶液,当沉淀质量达到最大值时,加入的NaOH溶液的体积是______mL,沉淀的最大质量是______g.(用含a?的代数式表示)
(3)继续加入NaOH溶液至沉淀不再发生变化时,过滤、洗涤并灼烧沉淀至恒重,所得残余固体的质量仍为a?g,计算原混合物中铝的质量分数(写出计算过程).
参考答案:(1)根据氢气体积,可以确定氢气物质的量为3.36L22.4L/mol=0.15mol,则反应的氢离子的物质的量为0.15×2=0.3mol,
HCl溶液中HCl物质的量为0.2L×5mol/L=1mol,则盐酸未完全反应.
根据Mg和Al与盐酸的反应可知,当氢气的量固定时,合金全为Mg时合金质量最大,当合金全为Al时合金质量最
? Mg~H2? ?2Al~3H2?
? ?0.15mol? 0.15mol?0.1mol?0.15mol
所以两种状况下合金质量分别为:Mg:0.15mol×24g/mol=3.6g,Al:0.1mol×24g/mol=2.7g,
故答案为:2.7<a<3.6;
(2)根据反应过程我们可以发现
? ?Mg~H2~2HClH~Mg2+~2NaOH~Mg(OH)2
? Al~32H2~3HCl~Al3+~3NaOH~Al(OH)3
HCl(过量)~NaOH,故此不难发现,新引入的NaOH的物质的量与酸的物质的量相等,
酸的物质的量为0.2L×5mol/L=1mol,故NaOH的物质的量亦为1mol,NaOH溶液体积为1mol4mol/L=0.25L=250mL,
由于沉淀当中只引入了OH-,故沉淀质量应为原合金质量a加上新引入的OH-的质量,而引入的OH-的物质的量为氢气物质的量的2倍,
所以沉淀的质量为:3.36L22.4L/mol×2×17g/mol+ag=(a+5.1)g,
故答案为:250;(a+5.1)g;?
(3)这一问我们依然需要通过宏观物质变化思考:易知最终物质为MgO,而最终MgO的质量与最初合金的质量相等,故可知合金当中Al元素的质量与MgO中O元素的质量相等,
所以合金当中Mg与Al的质量比即为MgO中Mg与O质量比相等,而MgO当中两元素质量比即为原子量之比,故合金当中Al质量分数为:w(Al)=[16/(24+16)]×100%=40%?
答:原混合物中铝的质量分数为40%.
本题解析:
本题难度:一般
3、选择题 除去镁粉中的少量铝粉,可选用( )
A.硫酸
B.氢氧化钠溶液
C.水
D.盐酸
参考答案:B
本题解析:A、D选项由于镁粉、铝粉均能与硫酸、稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故A、D错误。
C、镁粉不与氢氧化钠溶液反应、但铝粉能与氢氧化钠溶液反应、反应时能把杂质除去,而且原物质也保留,符合除杂原则,故B正确。
C、镁粉能与热水反应,铝粉不能反应,不符合除杂原则。故C错误。
点评:本题考查除杂,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)。
本题难度:一般
4、填空题 取等物质的量的MgO和Fe2O3的混合物进行铝热反应,反应的化学方程式为 ,引发铝热反应的实验操作是 。进行铝热反应时,内层纸漏斗底部剪一小孔用水润湿的目的是 。?
参考答案:2Al+Fe2O3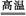 Al2O3+2Fe(2分)
Al2O3+2Fe(2分)
加少量KClO3,插上镁条并将其点燃(2分)
使熔融物易于落下且防止纸漏斗着火(2分)
本题解析:铝热反应只能冶炼活泼性比铝弱的金属,所以只有2Al+Fe2O3 Al2O3+2Fe一个反应发生。铝热反应需要高温,我们可以用镁条引燃。反应产生高温可以使金属熔化,在内层纸漏斗底部剪一小孔并用水润湿可以使熔融物顺利落下并防止纸漏斗着火。
Al2O3+2Fe一个反应发生。铝热反应需要高温,我们可以用镁条引燃。反应产生高温可以使金属熔化,在内层纸漏斗底部剪一小孔并用水润湿可以使熔融物顺利落下并防止纸漏斗着火。
本题难度:简单
5、选择题 一定量的铝铁合金与300mL 2mol/L的硝酸完全反应,生成3.36L NO(标准状况),三价铁盐和铝盐等,向反应后的溶液中加入3mol/L NaOH溶液恰好使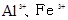 完全反应并生成沉淀最多,则所加入NaOH溶液的体积是
完全反应并生成沉淀最多,则所加入NaOH溶液的体积是
A.150mL
B.300 mL
C.450 mL
D.600 mL
参考答案:A
本题解析:
正确答案:A
n(NaOH)=n(NO3―)=0.3?L×2mol/L―3.36L/22.4mol/?L=0.45mol
所加入NaOH溶液的体积是0.45mol÷3mol/L=0.15L,A正确。
本题难度:一般